【5.1.1】脂质纳米颗粒和脂质体(Lipid Nanoparticles and Liposomes ),实现临床突破(LNP)
脂质体(Liposomes)、脂质纳米颗粒 (LNP,Lipid Nanoparticles) 和其他基于脂质的制剂已被临床证明可提高多种活性药物成分 (API,,active pharmaceutical ingredients) 的治疗指数。脂质是一类两亲性(amphipathic)生物分子,当掺入药物产品中时,它们表现出理想的安全性和药代动力学特征。最近,由于将 LNP 纳入基于信使 RNA (mRNA) 的疫苗配方,旨在防止 COVID-19 大流行的传播,因此在全球范围内受到广泛关注。LNP 纳米技术已迅速成为基因治疗和其他复杂注射药物产品的首选药物递送系统 (DDS,drug delivery system),代表了纳米医学的未来。
一、胃肠外剂型的脂质溶液
长期以来,脂质体已被确定为 API 的有效药物递送载体,具有较差的药代动力学、有限的生物利用度或溶解度以及高毒性。1960 年代由 Alec D. Bangham 发现,脂质体最初被用作人工双层来研究膜的生物物理特性。脂质体形态可以描述为被一个或多个脂质双层包围的水性核心,脂质相优选为圆柱形空间填充脂质分子。两亲性双层,通常由磷脂和甾醇组成,类似于生物细胞膜,促进细胞内吞作用和随后的细胞摄取。在 1970 年代 Gregory Gregoriadis 的努力下,脂质体被揭示为制药应用的理想 DDS 解决方案。这项研究将提供有关纳米药物物理特性与体内生物环境之间复杂关系的第一个知识。到 1995 年,多柔比星 (Doxil®,doxorubicin ) 的脂质体制剂将成为第一个获得 FDA 批准的纳米 DDS。
无论是由合成脂质成分还是天然脂质成分组成,常规脂质体都具有高度的通用性,并且作为多功能赋形剂在靶向药物递送、成像和诊断方面得到了广泛的研究。为了寻求基于脂质的 DDS 的替代组装方法,Demetrios Papahadadjopoulos 将支持反相蒸发 (RPE,reverse-phase evaporation ),这是一种在生产过程中使用水性和有机溶剂组合封装 API 的高度可重复的工艺。最终,Batzri 和 Korn 将建立乙醇注射方法,将溶解在乙醇中的脂质注射到过量的水性缓冲液中,形成纳米级胶体分散体。
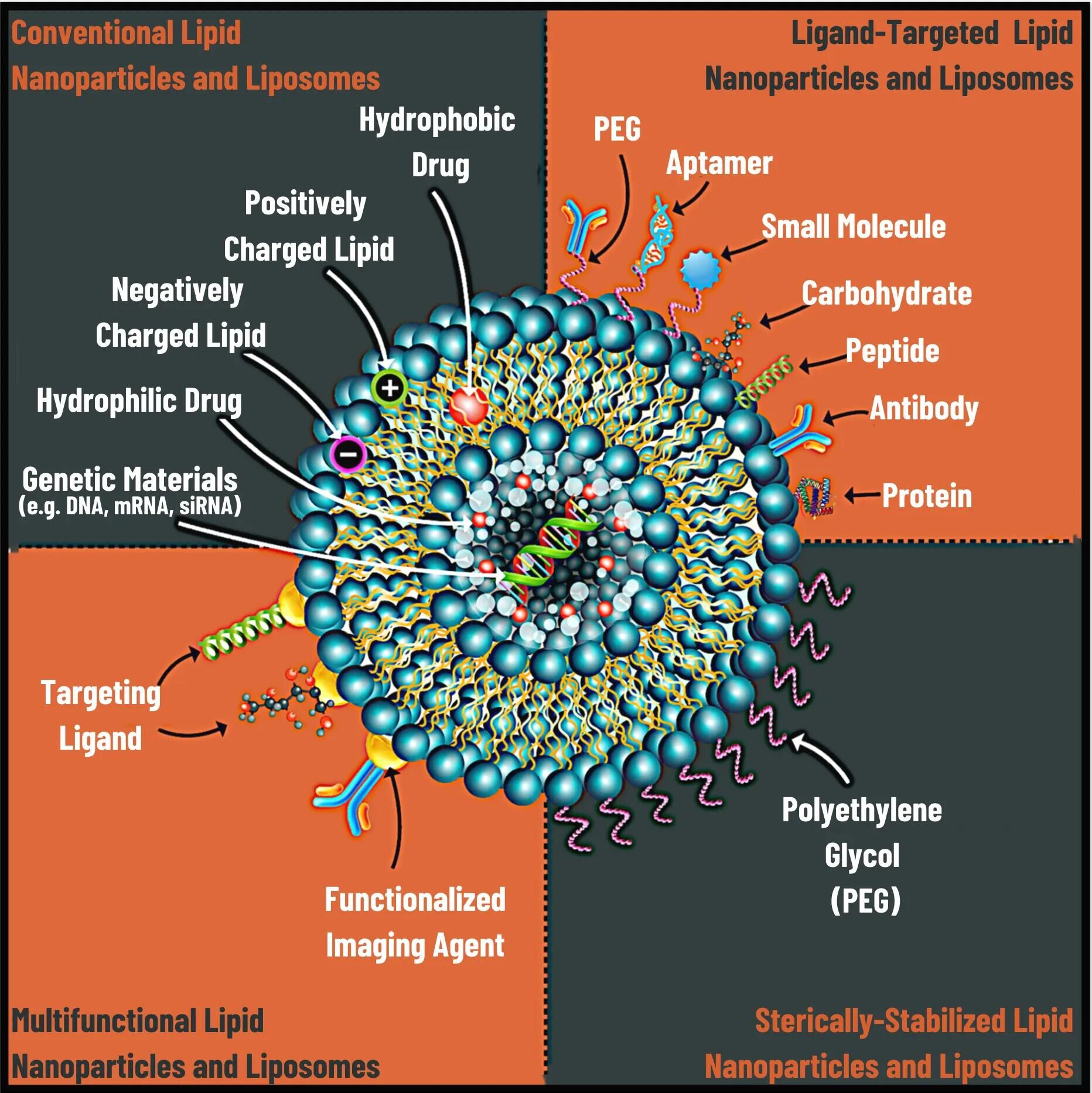
Figure 1: Conventional liposomes have been modified for a wide variety of clinical applications.
二、核心问题:固体脂质纳米颗粒和纳米结构脂质载体 SOLID LIPID NANOPARTICLES AND NANOSTRUCTURED LIPID CARRIERS
固体脂质纳米颗粒 (SLN,Solid lipid nanoparticles) 是基于脂质的纳米载体,由高相变脂质制成,在体温下为固体,并通过乳化剂稳定。SLN 具有与脂质体不同的形态,因为它包含固体脂质内部,在电子显微照片中显示为电子致密核心。SLN 可以在纳米级尺寸范围内制造,并且与非极性 API 具有良好的长期稳定性。不幸的是,SLN 显示出较差的载药效率并且表现出难以控制的药物释放特性。最近,设计了生产具有固相和液相脂质成分的纳米结构脂质载体 (NLC,nanostructured lipid carriers ) 的先进方法,以克服 SLN 的局限性。NLC 显示脂质基质核心的载药量有所提高,并显示出理想和可预测的药物释放曲线。
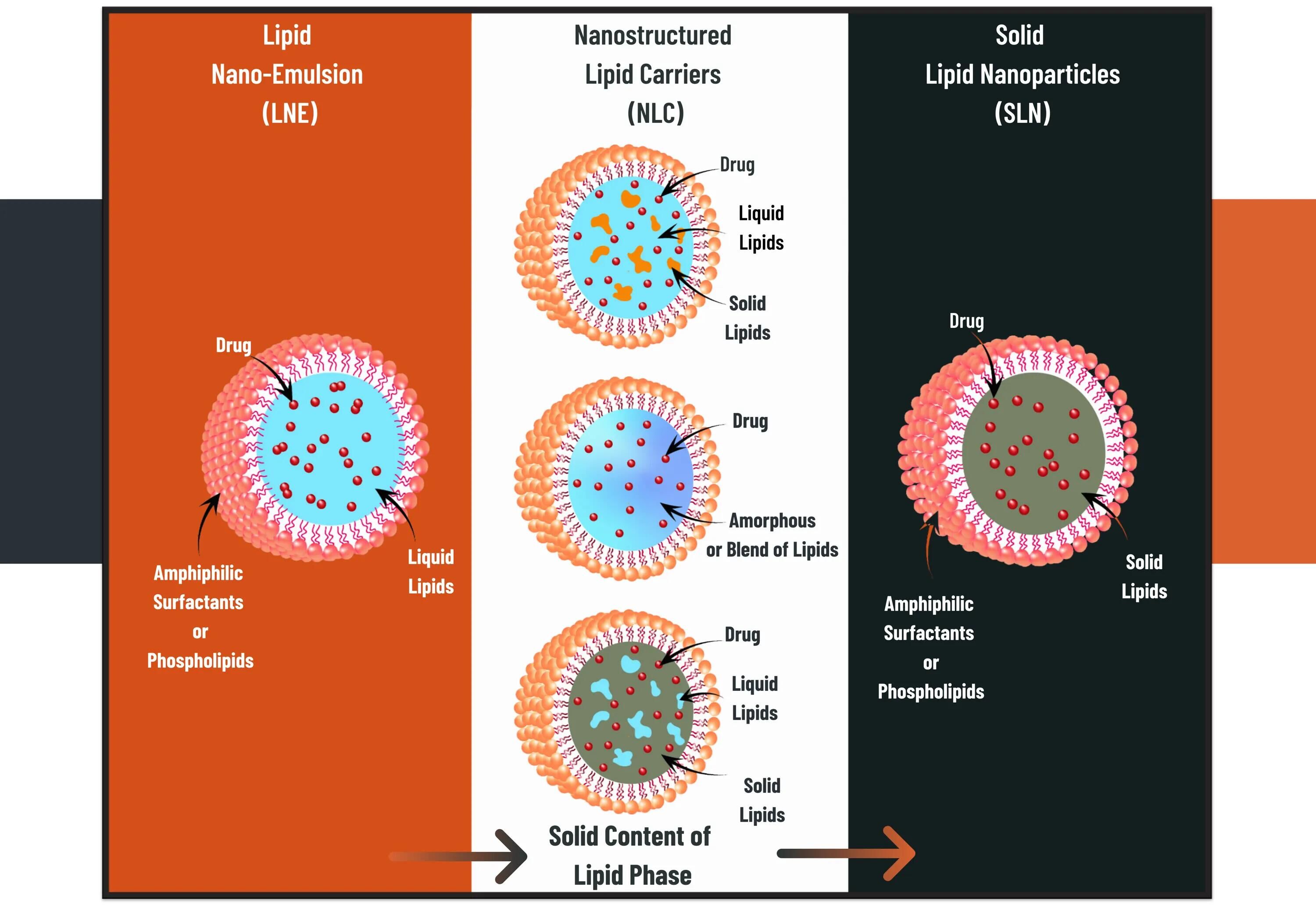
Figure 2. Structure of LNP, from lipid nano-emulsions to solid lipid nanoparticles (SLN). Nanostructured lipid nano-carriers (NLC) contain a blend of solid and liquid-lipid phases ideal for increased-loading capacity and controlled drug release profiles.
三、基因治疗和 mRNA 疫苗:基因有效载荷的传递解决方案
通过表达治疗性或突变蛋白、沉默病理基因或编辑患者的天然基因组来治疗罕见和以前无法治愈的疾病的能力已成为临床现实。目前已获批或处于后期临床试验的核酸疗法的例子包括反义寡核苷酸 (ASO)、小干扰 RNA (siRNA)、信使 RNA (mRNA) 和质粒 DNA (pDNA)。mRNA 疫苗的出现,即病毒抗原在免疫前由宿主细胞机制表达,使研究人员能够以前所未有的速度开发出应对 COVID-19 大流行的解决方案。这主要是由于 LNP 作为 mRNA 和 DNA 等基因有效载荷的有效和安全递送剂,在临床和商业上取得了 20 多年的成功。考虑到人类基因组中的任何基因都是可药物治疗的,基因疗法有望成为现代医学的未来,并使研究人员能够克服罕见的、无法治愈的疾病。唉(Alas),核酸是易挥发的,需要一种载体来保护遗传货物并促进体内进入靶细胞。
用基于脂质的制剂封装和递送 DNA 和 RNA 的最初努力涉及使用中性、两性离子脂质制剂的被动封装策略。为了提高通常昂贵的核酸有效载荷的加载效率,将阳离子脂质(例如,DOTAP、DOTMA)掺入脂质体制剂中,以通过静电脂质/DNA 脂质复合物促进封装。Lipoplex 介导的基因治疗递送已在体外转染实验中显示出相当大的实用性(例如,Lipofectamine®)。然而,络合过程参数是自发的且难以控制,导致颗粒具有从纳米级到几微米的宽尺寸分布。根据 FDA 对 GMP 药品制造商的指导,控制颗粒大小和颗粒分布对于任何基于脂质的药物递送系统都很重要。随着纳米医学中基于脂质的溶液的制造方法的进步,重点已转移到 LNP 形态,用于在制药行业中递送核酸。
四、脂质纳米粒子:固体脂质纳米粒子 (SLN,Solid Lipid Nanoparticles) 和纳米结构脂质载体 (NLC,Nanostructure Lipid Carriers)
在对抗 COVID-19 的过程中开发 mRNA 疫苗是 21 世纪最重要的医学发现之一。可以预见,LNP 制剂正迅速成为核酸递送的黄金标准。LNP 制剂的初步研究始于脂质-核酸复合物的自发组装,内化并稳定在脂质核心中, 类似于本文讨论的 NLC 形态。
第一个 LNP 制剂采用洗涤剂透析方法进行生产,通常用于将亲水性 API 封装在混合 NLC 制剂中。可电离阳离子脂质的引入与乙醇注射和微流体技术相结合,提供了一种可扩展的制造方法,可在直径小于 100 nm 的单分散 LNP 中实现核酸的高负载效率。这些 LNP 系统表现出低表面电荷,有助于克服体内显着的毒性和药代动力学问题。
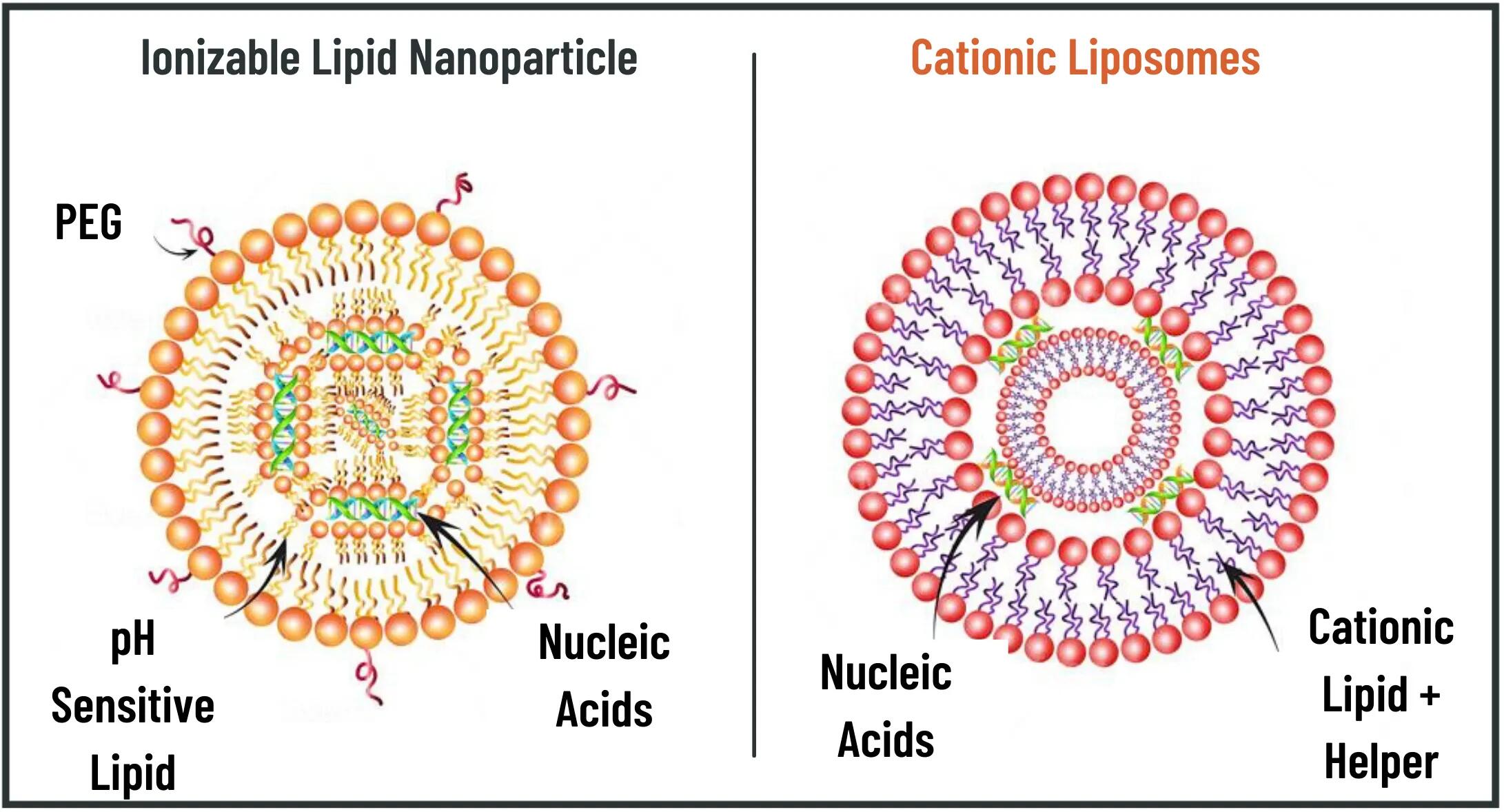
Figure 3. Comparison of lipoplex and LNP morphology with encapsulated nucleic acid cargo
五、其他
参考资料
