【9.8.1.2】体外转录 mRNA 的核苷修饰,以降低免疫原性并改善预防性和治疗性抗原的翻译
RNA分子容易被核酸酶降解并被先天免疫系统识别。磷酸盐主链、糖和/或核碱基的化学修饰有助于增强对降解的抵抗力,同时减少免疫传感器的识别,并且已被证明对于几种基于小 RNA 的疗法(i.e., Onpattro and Givlaari)从实验室到临床的转化至关重要。与在抗击 COVID-19 大流行的斗争中脱颖而出的其他疫苗平台(即 Comirnaty 和 Spikevax)相比,使用体外转录 (IVT) 产生的 RNA 分子表现出优越的性能。本章讨论先天免疫传感器识别 RNA 的要素、体外转录 RNA免疫原性的起源,以及减轻免疫原性和改善 IVT 产生的 mRNA 翻译的策略。我们进一步讨论了不同的核苷修饰及其对 RNA 激活先天免疫系统和提高mRNA治疗潜力的影响。
一、介绍
核糖核酸(RNA) 是聚阴离子杂聚物,在蛋白质翻译和基因调控中发挥重要作用。基于 mRNA 的疗法的概念在三十多年前就出现了,当时Dimitriadis (1978)、 Malone、Felgner 和 Verma (1989)以及Wolff 等人。 (1990)提供了第一个证据,证明内源产生(从细胞中提取)和体外转录 (IVT) 的信使 RNA (mRNA) 可以传递到细胞和动物中进行蛋白质表达。临床前模型和人类治疗性蛋白质替代(Rizvi 等人,2021)、基因编辑( Gillmore 等人,2021; Musunuru 等人,2021)、免疫疗法、癌症和疫苗(( Alameh、Weissman 和 Pardi,2020); Mullard,2021)强调了该平台的巨大潜力( Chaudhary、Weissman 和 Whitehead,2021)。
尽管初步研究取得了令人鼓舞的结果(Conry等人,1995;Hoerr,Obst,Rammensee和Jung,2000),但由于半衰期短和/或炎症介导的蛋白质翻译抑制,导致强烈的炎症、体内翻译减少,理化不稳定性、对核酸酶的敏感性增加以及转染不良被迅速认为是限制该技术进入临床用于治疗目的的潜力(例如蛋白质替代)的额外主要缺点。 这些缺点被认为对于疫苗应用和佐剂的开发(例如,CureVacRNActive 平台)很重要。
最近的技术进步,例如
- 掺入天然存在的修饰核苷、去除污染物、序列工程、新颖的帽部分/帽策略和密码子优化(Pardi、Hogan 和 Weissman,2020)
- 以及有效且相对安全的递送系统的开发(Buschmann 等人,2021)
在 COVID-19 大流行期间基于 mRNA 的疫苗的成功及其监管批准中发挥了至关重要的作用。
在本章中,我们回顾了先天免疫系统识别 RNA 的要素,并介绍了细胞如何进化来区分内源性和外源性核糖核酸。在“内源性和外源性RNA的区分”一节中,我们讨论了体外转录的mRNA免疫原性的起源,以及降低其免疫原性和改善翻译的策略。我们进一步讨论了不同的核苷修饰及其对 RNA 激活先天免疫系统和提高体外转录 mRNA 治疗潜力的能力的影响。我们通过强调下一代 mRNA 疗法的潜在重要领域来结束本章。
二、核酸和先天免疫
在本节中,我们介绍对核酸的先天免疫反应,并讨论对先天免疫反应至关重要的受体或传感器。这些受体或传感器在特定病原体检测中的参与超出了本章的范围,读者可以参考之前的优秀评论(Iwasaki & Medzhitov, 2015 ; Kawai & Akira, 2006 ; Medzhitov, 2007 ; Rivera ,锡拉库扎,Yap 和 Gause,2016)。相反,我们将重点关注一般概念,并在本章后续章节中强调这些受体/传感器在感测体外转录 mRNA 以及较小程度上小干扰 RNA (siRNA) 中的作用。
先天免疫系统在检测和消除病原体以及启动适应性免疫反应方面发挥着至关重要的作用。先天反应是非特异性的,几乎所有细胞都会促进,但对于 RNA 来说,抗原呈递细胞 (APC) 是关键群体。树突细胞 (DC) 和巨噬细胞 (Mφ) 通过保守的基序或结构域识别病原体,这些基序或结构域称为位于细胞表面的病原体相关分子模式 (PAMP)。称为病原体识别受体 (PRR) 的专门受体或传感器与含有大分子的 PAMP 之间的相互作用会触发 PRR-PAMP 分子复合物的构象变化,导致接头/伴侣蛋白(例如 MyD88、TRIF)的募集,然后被激活细胞内信号传导,以及通过信号级联和转录因子的激活诱导从头基因表达(图7.1)。这些事件导致先天免疫细胞的成熟和激活、细胞因子的分泌、归巢至淋巴器官、处理、抗原呈递以及适应性免疫系统的激活;读者可参考以下评论(Iwasaki & Medzhitov,2015;Medzhitov,2007),以全面讨论先天免疫系统在激活和控制适应性免疫反应中的作用。
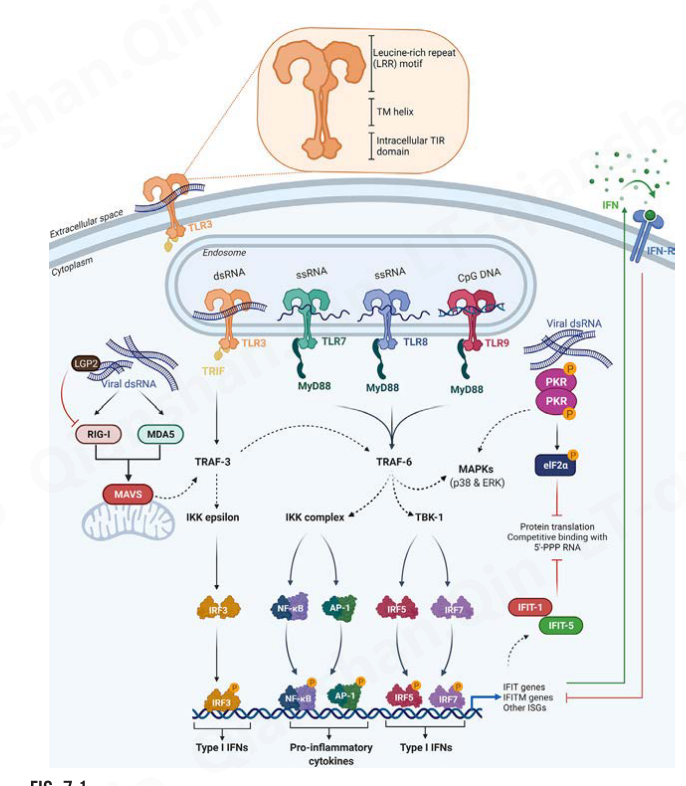
Fig. 7.1. Recognition of nucleic acid by endosomal TLRs and cytoplasmic molecular sensors. Following nucleic acid detection, endosomal TLRs 7, 8, and 9 engage MyD88 to activate TRAF-6 and transmit the activation signals to the transcription factors (i.e., NF-κB, AP-1, IRF-5, IRF-7) leading to their phosphorylation, dimerization, and translocation to the nucleus. TLR3 signals through TRIF, which recruits TRAF-3 leading to the activation of IRF3 and the TRAF-6 pathway which leads to the recruitment of NF-κB, AP-1, IRF-5, and IRF-7. Pathogen nucleic acids can also be detected by cytosolic RIG-I and MDA5 that will interact with MAVS leading to the activation of the TRAF-3 pathway. Transcription factors will lead to the expression of ISGs, such as IFIT and IFITM genes. The latter will result in protein IFIT-1 and IFIT-5 expression, implicated in the inhibition of protein translation and competitive binding with 5′-ppp RNA. TLR, Toll-like receptor; RIG-I, retinoic inducible gene-1; MDA5, melanoma differentiation-associated gene 5; IFIT, interferon induced protein with tetratricopeptide; ADAR, RNA specific adenosine deaminase; ssRNA, single-stranded RNA; dsRNA, double-stranded RNA; 5′-ppp, 5′ triphosphate; MAVS, mitochondrial associated antiviral signaling protein; MyD88, myeloid differentiation primary response 88; TRIF, TIR-domain-containing adapter-inducing interferon-β; MAPK, mitogen-activated protein kinase; ERK, extracellular signal-regulated kinase; IRF, interferon regulatory factors; AP-1, activator protein 1; NF-κB, nuclear factor-κB; TRAF, tumor necrosis factor receptor-associated factor; TBK, TANK-binding kinase; IKK, I kappaB kinases; TIR, Toll/interleukin-1 (IL-1) receptor domain; TM, transmembrane domain; ISG, interferon-stimulated gene; IFN, interferon; INFR, interferon receptor; LGP2, laboratory of Genetics and Physiology 2; PKR, RNA dependent protein kinase; eIF, elongation factor.
人们早已认识到细菌和病毒衍生的核酸 (NA,nucleic acids) 是哺乳动物先天免疫系统的有效佐剂 ( Isaacs, Cox, & Rotem, 1963 )。核酸感应和随后激活先天免疫反应的机制仍然难以捉摸,直到发现 Toll 样受体 (TLR) ( O’Neill, Golenbock, & Bowie, 2013 ) 和细胞质传感器,例如视黄酸诱导基因 I ( RIG-I)、黑色素瘤分化相关基因 5 (MDA5,也称为 IFIH1)、2'-5' 寡腺苷酸合酶(OAS)、环 GMP-AMP 合酶 (cGAS) 和黑色素瘤 2 中不存在的干扰素诱导蛋白(目标2);除其他抗病毒蛋白外。
- Toll 样受体 (TLR) 是跨膜蛋白,可通过其胞外富含亮氨酸重复序列 (LRR) 配体结合域识别 PAMP 和内源性配体,并通过其胞内高度保守的 Toll-白细胞介素受体 (TIR) 将信号传输至衔接蛋白)域(图7.1)。只有 10 个人类 TLR 和 11 个小鼠 TLR 的子集被证明能够感知核酸并做出反应。TLR3和 TLR7/8 识别双链 (dsRNA)(Alexopoulou、Holt、Medzhitov 和 Flavell,2001)和单链 RNA (ssRNA)(Heil 等,2004;Kariko、Buckstein、Ni 和 Weissman,2005) , 分别。TLR9被证明可以识别DNA中的 CpG 基序(Hemmi 等人,2000),由于我们重点关注基于核糖核酸的分子,因此本章将不再进一步讨论。
*TLR3在质膜和核内体上表达,并识别暴露于细胞表面或通过内吞作用进入细胞后的双链核酸(例如病毒) (Alexopoulou等人,2001)。它最初被鉴定为识别合成 dsRNA 类似物聚胞苷酸 (poly I:C) 的受体 ( Kawai & Akira, 2010 )。 TLR3 识别短 21 聚体 RNA 双链体和 ssRNA 复制过程中产生的 dsRNA(Kariko, Ni, Capodici, Lamphier, & Weissman, 2004;Kawai & Akira, 2008)。 Judge、Hornoung 和 Sioud 的工作中提出的证据表明,TLR3 并不是负责 siRNA 介导的免疫细胞激活的主要途径(Hornung 等人,2005;Hornung 等人,2006;Judge 等人,2005);法官,Bola、Lee 和 MacLachlan,2006;Sioud,2005)。
*TLR7、TLR8和 TLR13(小鼠)定位于内质网 (ER) 和内体-溶酶体区室( Heil 等,2003; Sellge & Kufer,2015 )。 TLR7和8具有双重特异性,并且感知小分子,例如鸟苷类似物(例如,Loxoribine)和咪唑喹诺酮衍生物(例如,R484),以及核糖核酸。结构分析和竞争性结合研究表明,R484 和核糖核酸结合 TLR7 受体胞外域(胞外域)上的不同位点。具体地,TLR7和8已显示识别合成的多聚尿苷序列(PolyU)、鸟苷/尿苷(PolyGU)序列、siRNA( Hornung等,2005 )和来自RNA病毒(例如甲型流感病毒)的ssRNA ,或细菌种类(例如B组链球菌)。
TLR 与其内体中同源配体的相互作用诱导接头蛋白的募集和随后的激活,例如含有 TIR 结构域的接头诱导干扰素-β(TRIF,也称为 TICAM1)或骨髓分化初级反应 88 (MyD88)。 MyD88 和TRIF依赖性途径均通过激活干扰素调节因子 (IRF) 3/7 诱导 I 型干扰素(INF) 和其他促炎细胞因子。这些 IRF 由 IKK 相关激酶、TANK 结合激酶 1 (TBK) 和 IKKi (IKKε) 通过TRAF3激活,TRAF3 充当 TRIF 和 TBK1 和/或 IKKi 之间的中间信号蛋白(图 7.1)。从头表达和分泌的 I 型 INF(即 INF-α/β)可诱导额外的抗病毒作用,并有助于在与其靶细胞上的受体结合后引发适应性免疫反应。
细胞质中存在的分子传感器和效应分子也可以感知核酸,诱导INF-α/β和促炎症反应,并介导先天免疫细胞的激活(图7.1)。这些胞质内传感器代表了第二层保护,它已经发展到抵消核酸的直接胞质负载或不良的 TLR 识别。
视黄酸诱导基因 I (RIG-I)、黑色素瘤分化相关基因 − 5 (MDA5) 和遗传学与生理学 实验室2 (LGP2,也称为 DHX58) 在细胞质中充当核酸传感器。这些蛋白质含有半胱天冬酶募集结构域 (CARD) 和解旋酶结构域;值得注意的是,LGP2缺少 CARD 域。 RIG-I 和 MDA5 通过其 C 端解旋酶结构域识别核酸,从而激活线粒体抗病毒信号蛋白(MAVS),并随后通过激活 IKKi/TBK1信号通路产生 INF-β 。 RIG-I 和核苷酸结合寡聚结构域 2 (NOD2) 被发现被短的无帽 dsRNA (< 300 bp) ( Kell & Gale Jr., 2015 ; Schlee et al., 2009 ) 和单链 RNA (ssRNA)激活)(Kato 等人,2008;Sabbah 等人,2009)。相比之下,MDA5 可检测长 dsRNA(> 2000 bp)、高分子量 ssRNA-dsRNA 复合物以及不含 2’O 甲基化核糖部分的mRNA 序列(Pichlmair 等人,2009;Zust 等人,2011) 。 LGP2(DEXH(Asp-Glu-X-His)盒多肽 58,DHX58)也识别长 dsRNA,并对细胞中的 MDA5 和 RIG-I 具有双重作用(激活 MDA5 并抑制 RIG-I)。
效应分子(例如存在于细胞质中)也可以感知 RNA 并介导蛋白质翻译的抑制并触发RNA 降解、抗病毒反应和细胞凋亡(Garcia 等,2006)。 RNA 依赖性蛋白激酶 R (PKR 或 EIF2AK2)是一种丝氨酸-苏氨酸激酶,通过其 N 端 dsRNA 结合域 (dsRBD) 结合 dsRNA,同源二聚化、自磷酸化,并通过真核翻译起始因子的磷酸化来抑制蛋白质翻译2α(eIF2α)(Anderson 等人,2010;Ehrenfeld 和 Hunt,1971)。 PKR 还可以通过 IKK-β 的直接磷酸化以及随后激活转录因子 NF-κB 来激活 NF-κB 信号通路。通过 eIF2α 磷酸化抑制细胞质中的翻译会阻碍病毒复制并引发细胞凋亡。 NF-κB 激活导致 INF-β、促炎细胞因子和干扰素刺激基因 (ISG) 的分泌。 PKR 可识别多种结构,包括 INF-γ 和 TNF-α mRNA 内的元件/结构、短和长 dsRNA、ssRNA 中的发夹结构、含有 5'-三磷酸的茎环结构和 siRNA(Zhang、Weinschenk、Guo,和施鲁森纳,2006)。
具有四类重复序列 (IFIT) 家族的干扰素诱导蛋白成员已被证明在核酸传感和抗病毒反应中发挥重要作用 ( Diamond & Farzan, 2013 )。 IFIT 蛋白识别含有三磷酸盐 (5'-ppp) 的 ssRNA ( Pichlmair 等人, 2011 ) 并且在 5' 末端缺乏 2'- O-甲基化 ( Hyde & Diamond, 2015 )。 IFIT蛋白是在大多数细胞类型中从头产生的,以响应内源性或外源性INF,或在TLR依赖性(TLR3)和独立性(RIG-I,MDA5)途径激活后(图7.1)。 IFIT通过与真核翻译起始因子 3 (eIF3) 翻译起始复合物的亚基结合并阻止其启动翻译过程来抑制蛋白质合成( Diamond & Farzan, 2013 )。实验数据表明,IFIT 蛋白以高亲和力与 5’ppp-mRNA 和 Cap0-mRNA 的 5' 末端区域结合,这表明了另一种抑制翻译的机制(Kumar 等,2014)。
2'-5'-寡腺苷酸合酶 (OAS)–2'-5' 寡腺苷酸依赖性核酸内切酶(RNAse L) 系统是另一种先天免疫途径,可感知外来核酸并通过降解细胞和病毒 RNA 来阻止病毒感染。 OAS 与 dsRNA 结合并催化 2'-5' 连接的腺苷酸寡聚物 (2'-5' A) 的产生; 2'-5’A 与RNAse L 的N 末端结构域的结合导致同二聚化和核酸酶结构域的激活。激活的 RNAse L 在 UU 和 UA 二核苷酸基序后切割 ssRNA。 RNA 特异性腺苷脱氨酶-1 (ADAR-1) 也被证明可以感知未修饰的 RNA,并触发腺苷到肌苷(A → I) 的转换或编辑。含有肌苷的 RNA 很容易出现翻译错误并被 RNAse L 降解。
通过这些不同途径的信号传导导致强效促炎细胞因子的表达,例如 I 型干扰素(例如 INF-β)、IL-6、IL-12 和 TNF-α,以及局部和/或炎症细胞因子的产生。或诱导和调节特定免疫反应的系统环境。 I 型干扰素刺激数百种不同基因的表达,从而增强 RNA 降解并抑制翻译。这些 INF 刺激基因 (ISG) 对白细胞募集和适应性免疫反应的启动具有免疫调节功能;先天免疫反应和适应性免疫反应之间的相互作用超出了本章的范围,感兴趣的读者可以参考 Iwasaki 和 Medzhitov 关于该主题的精彩讨论(Iwasaki & Medzhitov,2015)
三、内源性和外源性RNA的区分
如“核酸和先天免疫”部分所述,先天免疫系统识别外源核酸有助于防止微生物感染。然而,内源性核酸的异常识别会导致严重的自身免疫性疾病,例如系统性红斑狼疮、牛皮癣和 Aicardi-Goutieres 综合征以及其他 I 型干扰素病(Barrat、Elkon 和 Fitzgerald,2016;Mustelin、Lood 和 Giltiay,2019) 。为了开发新的疗法和改进基于核酸的疗法,必须了解细胞区分内源性和外源性核酸的机制。内源核酸传感可以通过多种策略来减少,包括(1)将受体或传感器空间限制在细胞中的特定位置/区室,以避免与内源核酸的物理相互作用,(2)受体或传感器的定向进化以识别特定的内源核酸通常不存在的模式/基序,(3) 核酸稳态,以及 (4) 化学修饰(包括编辑)。
TLR 定位于核内体,其配体结合域被排除在细胞质之外,从而防止与内源性核糖核酸直接接触。相反,外源核酸,例如细菌和病毒RNA、化学合成的小干扰RNA和体外转录的mRNA,在内吞作用后与内体TLR直接接触。存在于细胞质中的分子传感器,如 RIG-I 和效应分子(表 7.1 )已经进化到能够识别影响核酸一级、二级和三级结构的特定模式/基序、核苷酸组成和化学修饰( Mauger 等人,2017)。 ,2019;托罗尼的纳拉加特拉和贝维拉夸,2011)。对此类标记的识别允许区分内源和外源核酸。例如,真核细胞中的mRNA 加帽和 CpG甲基化分别在翻译和基因表达以及逃避 RIG-I ( Schuberth-Wagner et al., 2015 ) 和TLR9传感中发挥重要作用。核酸降解、细胞质定位的控制、衰变和区室化在最大限度地减少内源核酸和细胞质免疫传感器之间的相互作用中发挥着重要作用。编码核酸酶(例如 DNase II 和 III)的基因突变会导致内源性DNA的积累,增强干扰素信号传导和多个器官的炎症(Morita 等,2004;Mustelin 等,2019;Rodero 等,2017)。
依赖于使用与特定核苷酸反应的化学物质的新技术,加上下一代测序和质谱技术的进步,有助于识别 RNA 景观中的 150 多个修饰(Boccaletto 等人,2018;Harcourt、Kietrys 和 Kool, 2017;科赫,2021)。mRNA编码区中鉴定出的六种修饰包括N 1 -甲基腺苷(m 1 A)、N 6 -甲基腺苷(m 6 A)、假尿苷(ψ)、肌苷(I)、5-甲基胞苷(m 5 C)和5-羟甲基cidine (hm 5 C) ( Harcourt et al., 2017 )。这些修饰代表每个 mRNA 转录本中各自规范碱基的 0.01% 至 0.5%,并发生在特定位置,强调它们在细胞过程和 mRNA 生物学调节中的重要性(Schaefer、Kapoor 和 Jantsch,2017)。其中一些修饰是可逆的(例如,m 6 A),并且可以通过所谓的写入酶和擦除酶(表7.2)添加到核酸序列中或从核酸序列中删除(表 7.2),表明涉及需要严格和快速控制的过程(Harcourt 等人,2017 年;Schaefer 等人,2017 年);感兴趣的读者可以参考讨论核苷修饰在体内平衡和疾病中的重要作用的优秀评论(Barbieri & Kouzarides, 2020;Shulman & Stern-Ginossar, 2020)。

Kariko 和 Weissman 证明,来自不同亚细胞区室的 RNA 具有刺激细胞因子产生的独特倾向(Kariko 等,2005)。修饰核苷的掺入,例如假尿苷 (ψ) 和其他天然存在的修饰(例如,m 5 C、m 6 A、m 5 U、s 2 U)减少了 TLR7/8 介导的免疫刺激,表明核苷修饰发挥着至关重要的作用在内源/外源核酸传感范例中的作用(Kariko 等人,2005)。
核碱基上化学基团的添加、去除或取代对核酸分子的电荷、极性和结构有直接影响。在自然界中,所有这些修饰都发生在 Hoogsteenpane 上,以避免沃森-克里克碱基配对的改变。添加相对较小的疏水基团,例如甲基 (CH 3 ),会影响 RNA 二级和三级结构,以及通过碱基堆积、碱基配对、蛋白质相互作用和热力学变化的反应性,从而与另一种构象相比,有利于一种构象(Harcourt 等人, 2017 年;莫赖斯、阿达奇和余,2021 年)。这种结构的变化对核酸的半衰期、亲和力、翻译和先天免疫传感器的识别有直接影响(Andries等人,2015;Braasch等人,2003;Dong,Siegwart和Anderson,2019;Harcourt等人,2017;Kanasty、Whitehead、Vegas 和 Anderson,2012;Kariko 、Muramatsu、Keller和Weissman 等人,2021;
四、体外转录RNA免疫原性的起源
在本节中,我们将描述体外转录的过程,并回顾体外转录的 mRNA 免疫原性的起源。
体外转录 (IVT) 是一种简单直接的程序,可实现 mRNA 分子的模板指导合成。转录模板可以是线性化脱氧核糖核苷酸质粒 (pDNA)、聚合酶链式反应(PCR)的产物或两个退火的寡核苷酸(ON)。无论模板格式如何,它都必须在要转录的区域上游包含启动子序列(图7.2)。 DNA 依赖性 RNA聚合酶(RNAP;例如 T7 聚合酶)在与模板启动子结合并生成 8-12 个核苷酸引物后启动RNA 合成( Steitz,2009 )。RNAP催化核苷酸的 3' 羟基 (3’OH) 与传入核苷 5'-三磷酸 (rNTP) 的 α-磷酰基之间的亲核 (S N 2) 攻击或取代,形成磷酸二酯键(PO43 -)。该Mg2 +依赖性反应将核苷单磷酸(NMP)添加到新生RNA中并释放焦磷酸(PPi)(图7.2)。当聚合酶离开模板末端时,转录终止(也称为径流转录)(图 7.2)。基于上述反应机制,体外转录的mRNA含有5’三磷酸(5'-ppp)、核糖核苷酸(例如腺苷、胞苷、尿苷和单磷酸鸟苷)和3'-OH基团。
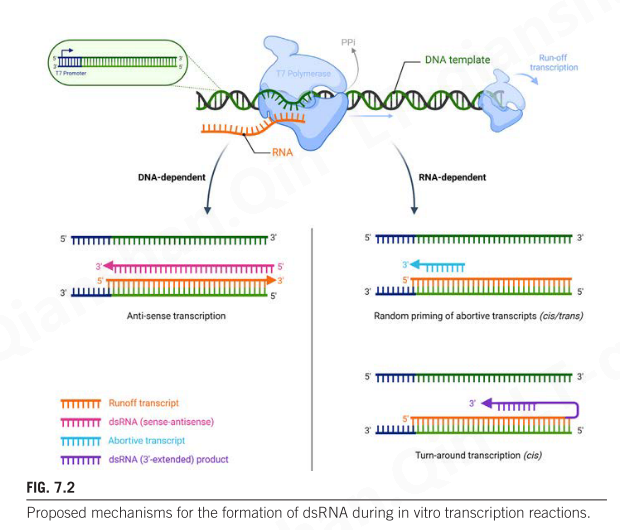
尽管原则上简单明了,IVT 反应会产生多种污染物和副产物,例如短的流产(short abortive, 约 2-8 个核苷酸)(Brieba & Sousa, 2001;Cazenave & Uhlenbeck, 1994)、过早终止(prematurely terminated,Krupp, 1988)和双链 RNA 产品(double-stranded, Kariko、Muramatsu、Ludwig 和 Weissman,2011)。由于热力学不稳定和酶的初始衰减,在转录反应起始期间会产生大量短的无效产物(Brieba & Sousa,2001 )。这些产物通过消耗反应混合物中存在的可用核糖核苷酸而降低反应产率。这些产物的消除非常简单,可通过乙醇沉淀、纯化色谱或切向流过滤 (TFF) 来实现。相反,dsRNA(体外转录的主要副产物)需要至少一个(例如,临床前应用)或多个纯化步骤(例如,临床应用)来消除。双链RNA产物是免疫反应的有效激活剂,并被内体(TLR3)和细胞质RNA传感器(例如MDA5、PKR)识别(图7.1,表7.1)
不同类型 dsRNA 副产物的起源归因于 IVT 反应期间可能发生的多种机制(Biebricher & Luce, 1996 ; Cazenave & Uhlenbeck, 1994 ; Gholamalipour, Johnson, & Martin, 2019 ; Gholamalipour, Karunanayake Mudiyanselage, & Martin,2018;Mu、Greenwald、Ahmad 和 Hur,2018),以及 RNAP 充当 RNA 依赖性 RNA 聚合酶的能力(Arnaud-Barbe、Cheynet-Sauvion、Oriol、Mandrand 和 Mallet,1998;Cazenave 和 Uhlenbeck,1994)。
- 第一种类型的 dsRNA 污染物是当短的失败产物(4-6 个核苷酸)或过早产物在径流转录物上退火并通过 RNAP 通过其 RdRNP 活性延伸时产生的(图 7.2)。
- 当径流产物以顺式(同一分子内)或反式(反应中的不同分子)与互补序列退火并进行 3' 延伸时,就会形成第二种类型的 dsRNA 污染物(Gholamalipour 等人)。
- 第三种类型的 dsRNA 污染物是由反义 RNA 分子与径流转录本退火形成的(图 7.2)。吴等人研究表明,当 RNAP 以启动子和终止转录物独立的方式启动转录时,就会形成反义 RNA 分子 ( Mu et al., 2018 )。 T7 酶的这种异常的无启动子转录活性可以通过添加修饰核苷 (modNTP)、降低缓冲液的镁含量以及使用模板编码的聚腺苷尾 (polyA 尾) 来抑制 ( Mu et al., 2018;Wu、Asahara、Tzertzinis 和 Roy,2020)。另一种机制是聚合酶到达 DNA 末端并改变方向而不是脱落。
由于体外转录反应产生含有 RNA 和 dsRNA 污染物的 5' 三磷酸,因此体外转录产物诱导先天免疫传感器(例如 TLR3、RIG-I、MDA5、PKR 和 AOS)并被认为具有免疫原性和不适合在很长一段时间内用于治疗应用。
五、降低 RNA 免疫原性并改善体外转录 mRNA 序列翻译的策略
如上一节所述,IVT mRNA 有可能通过识别未加帽的 5' 三磷酸和/或污染物(例如 dsRNA)来激活多个 PRR。然而,使用色谱方法消除 dsRNA 以及加帽 5' 末端并没有减轻免疫刺激(Kariko 等人,2011),这凸显了其他因素(如核苷修饰和结构)的重要性。
在本章的这一部分中,我们讨论用于降低 RNA 免疫原性和改善体外转录 mRNA 翻译的策略。这些策略对于将治疗性 RNA 推进临床试验以及辉瑞/BioNTech 和 Moderna Therapeutics 的 COVID-19 疫苗的功效得到证实至关重要(Kariko 等人,2011 年;Nance 和 Meier,2021 年;Rosa、Prazeres、Azevedo) ,&马克斯,2021)。
加帽 5' 三磷酸末端以降低免疫原性并改善体外转录 mRNA 的翻译 真核 RNA 含有 5' 三磷酸基团,该基团会被快速消除,以防止细胞质中存在的先天免疫受体进行内源性感应。核糖体 (rRNA) 和转移 RNA (tRNA) 被加工成 5' 单磷酸。信使 RNA在转录过程中被 7-甲基鸟苷帽 (m 7 G) 修饰,并已被证明对于前 mRNA 剪接、聚腺苷酸化和核输出至关重要。在细胞质中,m 7 G 帽已被证明可以通过招募翻译起始因子(例如 eIF4E)和增强 RNA 闭环模型来促进蛋白质生物合成。 m 7 G 加帽在mRNA 代谢中发挥着重要作用,通过增加核酸外切酶抗性(减少降解)来延长半衰期,并有利于上述 RNA 闭环模型。最近的研究结果表明,细胞质脱帽是一个高度调控的过程,在 mRNA稳态中发挥作用( Song、Li 和 Kiledjian,2010)。
体外转录的 mRNA 可以在消除短的流产产物和其他污染物后通过酶法加帽,或者在体外转录过程中添加帽类似物(共转录加帽)(Kwon 等人,2018 )。基于痘苗病毒加帽酶(VCE) 的酶加帽是一种高效且完善的工艺,可用于小规模和大规模以合并 cap 0 和 cap 1 结构。牛痘加帽酶是一种异二聚体(D1 和 D12),执行加帽反应中的所有三个步骤,包括去除 5' γ-磷酸盐以形成 5' 二磷酸盐,以及随后将 单磷酸鸟苷(GMP) 转移至 5' γ-磷酸盐。 ' 二磷酸 (5'-pp) 利用其鸟苷基转移酶活性,导致形成未甲基化的帽 0 结构。cap0 在 N 7位上的甲基化发生在甲基供体(例如 S-腺苷甲硫氨酸)的存在下,通过 D1 亚基的鸟嘌呤-N 7-甲基转移酶活性形成 cap1(Kwon 等人,2018;Wen,Yue) ,&沙特金,1998)。添加 cap 0 结构并随后在 cap 1 中进行甲基化,通过减少与 RIG-I、IFIT-1 和 IFIT-5 等分子传感器的相互作用,改善翻译并降低体外产生的 mRNA 的免疫原性;Moderna Therapeutics 已使用该策略生产 mRNA-1273 COVID-19 疫苗 (Spikevax)( EMA,2021)。
与酶加帽相比,体外转录 RNA 的共转录加帽是一种更简单、更通用且更省时的方法。不对称加帽的历史问题,例如产量低和蛋白质翻译受损(Alton 等人,1999;Pasquinelli、Dahlberg 和 Lund,1995;Wolff 等人,1990),或由于 GTP 和帽类似物之间的竞争而导致不完全加帽(Kwon 等人,2018)随着抗反向帽类似物(ARCA)的开发得到了相对解决,以确保帽 0 的正确方向(Jemielity 等人,2003;Stepinski、Waddell、Stolarski、Darzynkiewicz 和 Rhoads, 2001)以及在反应中使用过量的帽类似物(Vaidyanathan 等人,2018)。然而,这些改进并没有减轻免疫原性,因为高达 30% 的转录本没有被限制,导致传感和翻译减少。
与多核苷酸连接的帽类似物(例如 CleanCap 技术)可确保 cap1 结构的正确方向,同时确保加帽效率高于 95%(Chivukula、Payne 和 Tanis,2019;Hogrefe、Lebedev、Mccaffrey 和 Shin,2015)并减轻核苷的免疫原性修饰的 mRNA。
核苷修饰可消除免疫原性并改善体外转录 mRNA 的翻译 几项研究报告称,将修饰核苷掺入 mRNA 后可减少炎症并增加蛋白质产量(Anderson 等人,2010;Andries 等人,2015;Antony、Dewerth、Haque、Handgretinger 和 Kormann,2015;Kariko 等人, 2008;Kariko 等人,2011;Mahiny 等人,2015;Svitkin 等人,2017 )。卡里科等人。结果表明,表达 TLR3、TLR7 和TLR8的人胚胎肾细胞 (HEK293)受到未修饰的 mRNA 的刺激。相反,修饰核苷的掺入,例如假尿苷(ψ)和其他天然存在的修饰(例如,m 5 C、m 6 A、m 5 U、s 2 U)减少了TLR7/8介导的免疫刺激。 TLR3 介导的免疫刺激在 m 6 A存在时被消除,可能是由于 dsRNA 结构不稳定(Kierzek & Kierzek,2003)(表 7.2)或体外转录过程中 dsRNA 含量减少所致。卡里科等人。证明短 RNA 双链体的单一修饰消除了单核细胞衍生的树突状细胞 (MDDC) 中的 TNF-α 诱导,而较长的转录物需要用一种或多种修饰核苷的组合进行完全修饰,以消除免疫刺激。修饰的 mRNA 的转染表明,只有尿苷修饰的转录本在原代人源性浆细胞样和单核细胞树突状细胞中没有刺激作用,突出了细胞类型对修饰 mRNA 的反应/敏感性的差异(Kariko、Buckstein、Ni 和 Weissman,2005,Kariko 等人) ., 2008 )。这些开创性的发现并没有调查所观察到的先天免疫激活抑制和 TLR 之外的分子传感器所涉及的确切机制。霍农等人。证实了我们实验室的初步观察结果(Kariko 等人,2005),即基于尿苷的核苷修饰消除了免疫反应,并表明 s 2 U 或 ψ 抑制了 RIG-I 的活性(Hornung 等人,2006)。核苷修饰改变了 RNA 分子的理化性质、结构和反应性,并且可以通过防止与先天免疫传感器的直接相互作用来赋予隐形特性。穆等人。表明核苷修饰通过减少合成过程中 dsRNA 副产物的形成来抑制 RIG-I/MDA5 激活 ( Mu et al., 2018 )。
除了抑制先天免疫反应外,ψ 修饰还被证明可以增加体外和体内蛋白质表达(翻译效率)(Kariko, Buckstein, Ni 和 Weissman, 2005 , Kariko, Muramatsu, Keller 和 Weissman, 2012 , Kariko 等人.,2008;Kormann 等人,2011;Vaidyanathan 等人,2018)。考夫曼等人。在证明未修饰与 ψ 修饰的 mRNA-LNP 给药的小鼠中蛋白质表达和免疫刺激没有显着差异后,表明 ψ 对于 mRNA 的治疗应用可能是不必要的(Kauffman 等人,2016)。这些矛盾的发现可能是由于递送系统、给药途径、靶器官/细胞和构建设计(例如尿苷消耗)的差异造成的。递送系统和构建设计是实验设计和数据解释过程中需要考虑的主要因素(Alameh 等人,2021;Thess 等人,2015)。例如,序列优化和尿苷去除可降低免疫原性并改善未修饰 RNA 的蛋白质表达(Thess 等人,2015;Vaidyanathan 等人,2018)。根据 Thess 等人开发的方法,将修饰的核苷(例如 ψ)掺入优化的序列中。对蛋白质表达产生负面影响(Thess et al., 2015)。这些结果并不令人惊讶,因为序列组成的修饰(%核苷酸和一级结构)或修饰核苷的引入会影响转录物的二级/三级结构(折叠)和解链温度,并可能因此影响翻译(莫格等人,2019)。
为了支持核苷修饰的重要性,Andries 等人。结果表明,N 1 -甲基假尿苷(m 1 ψ)通过增加蛋白质表达和降低体外转录mRNA的免疫原性而优于ψ(Andries等人,2015)。这种修饰的优越性能(Andries等人,2015;Parr等人,2020)有利于其在多个临床前的应用(Alameh等人,2020;Carrasco等人,2021;Chaudhary等人,2021;Corbett ) , Nason 等人, 2021 ; Corbett等人, 2021 ; Freyn 等人, 2020 ; Martinez 等人, 2021 ; .,2018;Tombacz等,2021 ;Vogel 等,2021;以及临床研究(Chaudhary 等, 2021 );Frenck Jr. 等,2021),目前用于已批准的辉瑞/BioNTech 和 ModernaTxCOVID-19 疫苗。斯维特金等人。使用无细胞翻译系统来排除免疫识别对蛋白质翻译的影响。作者发现,在 m 1 ψ 存在的情况下,多核糖体丰度和大小增加,表明翻译起始速度较快,延伸速度较慢,表达得到改善(Svitkin 等人,2017)。 m 1 ψ 修饰 RNA 的翻译改善和免疫原性降低是由于疏水甲基 (CH 3 ) 引起的结构变化,特别是在转录本的非翻译区域(Alameh 和 Weissman,未发表的数据)。
六、消除或预防体外转录过程中形成的 dsRNA 污染物
核苷修饰 RNA 体外转录过程中产生的 dsRNA 污染物负责激活 PKR 以及 AOS 等其他传感器/效应器(Anderson 等,2011,Anderson 等,2010),这解释了为什么掺入修饰的 RNA仅将核苷或序列优化引入 5' 加帽 mRNA 无法完全消除 I 型 INF 和促炎细胞因子的诱导( Andries 等人,2015;Kariko 等人,2005;Kauffman 等人,2016)。因此,已经开发了几种策略来消除体外转录后的 dsRNA 污染物(Baiersdorfer 等人,2019;Kariko 等人,2011)或最大限度地减少/消除转录反应过程中 dsRNA 的形成。
-
可以使用天然或变性凝胶电泳(GE)、毛细管凝胶电泳(CGE)、等速电泳( Rogacs、Marshall 和 Santiago,2014)或微流体装置根据核酸的分子量(大小)进行分离。电泳期间核酸的变性改善了分离(分辨率),但引入了不良的化学修饰,阻碍了其生物活性(Masuda、Ohnishi、Kawamoto、Monden 和 Okubo,1999)。无论使用何种方法/装置,上述技术都无法扩展到临床应用。近年来,人们探索了几种采用色谱技术的策略来克服核糖核酸纯化的挑战,并满足对治疗性 RNA 日益增长的需求;有兴趣的读者可参阅有关核糖核酸纯化主题的综合评论( Martins、Queiroz 和 Sousa,2014 年)。
-
使用离子对反相高效液相色谱 (IP-RP HPLC),已从核苷修饰的 mRNA 中消除了 dsRNA。 Kariko 和 Weissman 强调了严格纯化技术对于 mRNA 治疗性能的重要性,并表明使用 IP-RP HPLC 消除 99% 以上的 dsRNA 可改善 mRNA 表达,并消除先天免疫感应(Kariko、Muramatsu、Keller)和 Weissman,2012 年;Kariko、Muramatsu、Ludwig 和 Weissman,2011 年)。使用 IP-RP HPLC 大规模纯化体外转录的 mRNA 是不可行的。几种离子对剂和有机溶剂很难从最终产品中去除,可能需要额外的纯化(Gilar,2001),并开发分析测定法以证明完全消除此类化合物以达到监管目的。 IP-RP HPLC 通常需要在较高温度(例如 60 °C)下进行纯化,以避免富含 GC 或高度结构化的 RNA 聚集,从而增加温度介导的降解风险。此外,使用乙腈等有机溶剂存在环境问题,并且IP RP-HPLC中使用的树脂(例如烷基化无孔聚苯乙烯-二乙烯基苯共聚物微球)往往价格昂贵,并且仅具有中等结合能力。
Baiersdorfer 和 Kariko 开发了一种使用纤维素作为柱色谱树脂来消除 dsRNA 污染物的方法(Baiersdorfer 等人,2019)。新方法被证明具有成本效益、可靠、安全、可扩展,并且与我们实验室开发的 IP-RP HPLC 同等有效( Kariko 等人,2011)。与 Baiersdorfer 的发现非常一致,我们使用这种 mRNA 纯化方法的经验表明,在人单核细胞衍生的树突状细胞中消除了超过 96% 的 dsRNA(在 600-7000 个核苷酸范围内)并消除了 INF-α 表达(未发表的数据) )。据推测,纤维素和 RNA 悬浮液的离子强度和介电常数在纤维素和 dsRNA 之间的优先结合中发挥着重要作用。
- RNAse III 是一种双链 RNA 特异性核酸酶,被用作消除体外转录过程中形成的 dsRNA 污染物的替代方法(Foster 等人,2019;Meis、Person、Chin、Jendrisak 和 Dahl,2011)。该方法简单有效,消化后的 IVT mRNA 的生物活性得到改善,证明了这一点。然而,该方法的普遍适用性受到限制,因为单链 RNA 形成的二级结构可以在酶消化步骤中被识别和切割,使得该方法对于工业应用缺乏吸引力。
可扩展到工业制造的纯化技术,例如尺寸排阻色谱 (SEC) 和离子交换色谱 (IEX-C),已重新用于 mRNA 纯化。这些技术均具有局限性,只能通过使用多种纯化程序的组合来规避。例如,尺寸排阻色谱 (SEC) 是一种根据分子大小分离混合物组分的技术,无法分离或消除与体外产生的转录物互补的尺寸相似的污染物(Kim、McKenna、Viani Puglisi) ,&Puglisi,2007;McKenna 等人,2007)。由于 RNA 的聚阴离子性质,人们对离子交换色谱法,特别是阴离子交换 (AEX) 色谱法进行了探索。AEX主要依靠改变层析基质和 RNA 之间的静电相互作用来促进结合、洗涤过程中的保留以及目标产物的洗脱。值得注意的是,疏水相互作用有助于纯化,因为 AEX 基质往往具有轻微的疏水性。 AEX 选择性取决于核酸长度、组成,并且区分单链和双链序列的能力很大程度上取决于 GC 和 AU 碱基配对的疏水行为(Shanagar,2005)。大 mRNA(例如 600-4000 个核苷酸)只能在 50 至 70 °C 之间的温度下洗脱(Issa、Barberio 和 Grant John,2013)。改进的 AEX 树脂和方案已开发用于临床应用并消除短 RNA 和 dsRNA 污染物,但仍需要两步过程(Gagnon,2020)。
基于杂交亲和力的层析技术使用聚胸苷(例如,oligo-dT)或RNA 探针(例如,适体)来初始捕获体外转录产物(Nelson 等人,2020),但无法区分单个与 dsRNA ( Slater, 1985 )。这些技术可用于消除短的流产产物,并选择性地富集聚腺苷酸化转录物,从而消除不适合通过 SEC 或 AEX 消除的过早流产产物( Issa 等人,2013; Nelson 等人,2020)。
据报道,使用热稳定性 RNA聚合酶(例如高温 T7 RNAP)和模板编码的聚腺苷酸尾巴可显着减少高温体外转录过程中 dsRNA 的形成(Wu et al., 2020)。升高的反应温度会降低 T7 聚合酶非特异性结合在模板上并引发不依赖于启动子的聚合的倾向。模板编码的多聚腺苷酸尾有助于抑制 3'-延伸 ( Wu et al., 2020 )。根据我们的经验,使用热稳定 T7 聚合酶可减少 80% 左右的 dsRNA 形成,但会产生大量 (~ 20%) 过早终止的产物(未发表的数据)。改进反应条件和使用新型工程 T7 可能会提高反应产率和产品的质量属性。与温度介导的 dsRNA 形成减少相反,Mairhofer 等人。优化了规范的 T7 终止序列并将其克隆到感兴趣的基因下游(Mairhofer, Wittwer, Cserjan-Puschmann, & Striedner, 2015),以防止发酵过程中的通读转录。该方法可应用于体外转录,在模板编码的 PolyA 尾下游包含优化的 T7 终止子,以防止启动子较少的结合或 3' 延伸。
减少 dsRNA 形成的发明方法已被描述,包括添加与预期转录物 3' 末端互补的捕获核酸序列,以防止 RNA 自引发延伸( Gholamalipour 等人,2019)。该方法仅在 34-50 个核苷酸的短序列的体外转录过程中进行了测试,并且需要针对长 mRNA 转录物进行验证。
七、结论和未来展望
mRNA 疗法在过去二十年中取得了非凡的进展,首先是使用修饰核苷消除 mRNA 的先天免疫原性并进行纯化以消除污染物。其他重大进展包括改善 mRNA 半衰期和蛋白质表达的序列工程、mRNA 在疫苗和其他治疗适应症中的临床前应用,以及用于预防 COVID-19 的 mRNA 疫苗的大规模生产和监管批准的开发。
mRNA 疫苗和疗法的成功在很大程度上取决于产品质量属性,例如identity、纯度和向靶细胞/器官的递送。脂质纳米颗粒在 mRNA 疫苗的成功中发挥了重要作用,并且是迄今为止最先进的 mRNA 递送系统。具有改善的反应原性、表达和对细胞亚群的特异性靶向的脂质纳米颗粒仍然有利于基于 mRNA 的治疗的重复施用,以及它们在治疗特定适应症方面的成功。新型可电离脂质的设计、适合大规模生产的纳米颗粒靶向化学物质以及基因编辑的使用实际上将彻底改变下一代 mRNA 疗法。
mRNA 制造的各个方面,如减少污染物、提高纯化产量和保真度,以及开发更高分辨率的分析技术,都需要使技术大众化并指导基于 mRNA 的疗法的开发。为了充分利用这种变革性治疗方式的潜力,mRNA-LNP 的结构、功能、效力和佐剂性等生物学特征仍有待探索。解决这些问题以及更好地了解递送系统及其与免疫系统的相互作用将有可能有助于为当前的医学挑战提供解决方案,并定义细胞和基因治疗中 mRNA 疗法的下一个十年。
参考资料
https://www.sciencedirect.com/science/article/pii/B9780128215951000142
