【3.4.5.2】氢键
一、什么是氢键?
在含有N-H、O-H或F-H键的分子中,H原子与N、O或F原子之间电负性的巨大差异导致了高度极性的共价键(即键偶极)。
| 元素 | 电负性值 |
|---|---|
| H | 2.1 |
| N | 3.0 |
| O | 3.5 |
| F | 4.1 |
由于电负性的不同,H原子带有大量的部分正电荷,N、O或F原子带有大量的部分负电荷。
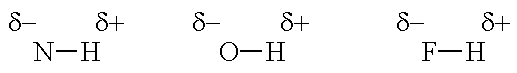
一个分子中的H原子被静电吸引到另一个分子中的N、O或F原子上。
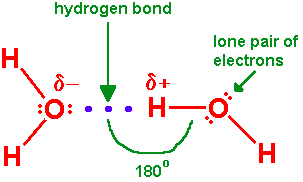
这种由与一个电负性非常大的原子(供体)(如N、O或F原子)共价键合的氢原子与另一个电负性非常大的原子(受体)的孤对电子之间的吸引力造成的相互作用称为氢键,它不是与氢原子的共价键。 主要通过静电吸引,供体原子与受体原子有效地分享其氢,形成氢键。氢键可以存在于不同分子的原子之间,也可以存在于同一分子的部分原子之间。
氢键比离子键或共价键弱,但比范德瓦尔斯力强。虽然氢键通常被认为主要或完全是静电性质的,但对氢键复合物的研究显示,许多氢键长度比供体和受体原子的范德瓦尔斯半径之和还要短,并显示出比预期的纯静电相互作用更大的角度限制,表明轨道重叠和部分共价特性。
二、氢键作用的后果
2.1 物理上
在25℃时,亚硝酰氟(ONF)是一种气体,而水是一种液体。为什么?
ONF和水的形状大致相同。ONF的分子量(49 amu)高于水(18 amu)。
结论:伦敦色散力不是造成这两种化合物之间差异的原因。
ONF和水具有相同的偶极矩。
结论:偶极-偶极力不是造成这两种化合物之间差异的原因。
ONF不能形成氢键;水可以形成氢键。由于水中广泛存在的氢键,水在很大的温度范围内是液态的。


2.2 化学/生物上
水也是离子化合物和许多其他化合物的良好溶剂,因为它很容易与溶质形成氢键。蛋白质分子中氨基酸之间的氢键很大程度上决定了它折叠成其功能结构的方式并稳定了蛋白的二级结构。DNA两条链上的核苷酸中的含氮碱基之间的氢键(鸟嘌呤与胞嘧啶配对,腺嘌呤与胸腺嘧啶配对)产生了双螺旋结构,这对于遗传信息的传递至关重要。
三、药物设计中的氢键
氢键是生物识别过程中最重要的特定相互作用,是药物分子和其局部环境之间的基本非共价相互作用之一。对于药物分子来说,这个局部环境可能是生物靶标、靶点之外的其他生物分子、水溶液、脂质膜,甚至是结晶固体。因此,氢键影响着对于药物设计至关重要的多种分子特性,包括效力,选择性,透膜性和可溶性。氢键的几何形状遵循一定规则,这些规则可以从晶体结构数据库中提取出来并用于药物设计。
3.1 氢键的长度
2010年的一篇针对CSD和PDB的数据挖掘分析文章显示:经典的氢键长度的概率分布曲线呈现一个尖锐的峰。在CSD中,酰胺C═O和OH之间的氢键的中位距离为2.75埃。当供体变为NH时,中位距离增加到约2.9埃。在PDB数据库中分析配体的结合位点区域,观察到相同的中位距离。PDB中的数据分布明显更宽,但仍然明显地相互分离开来。
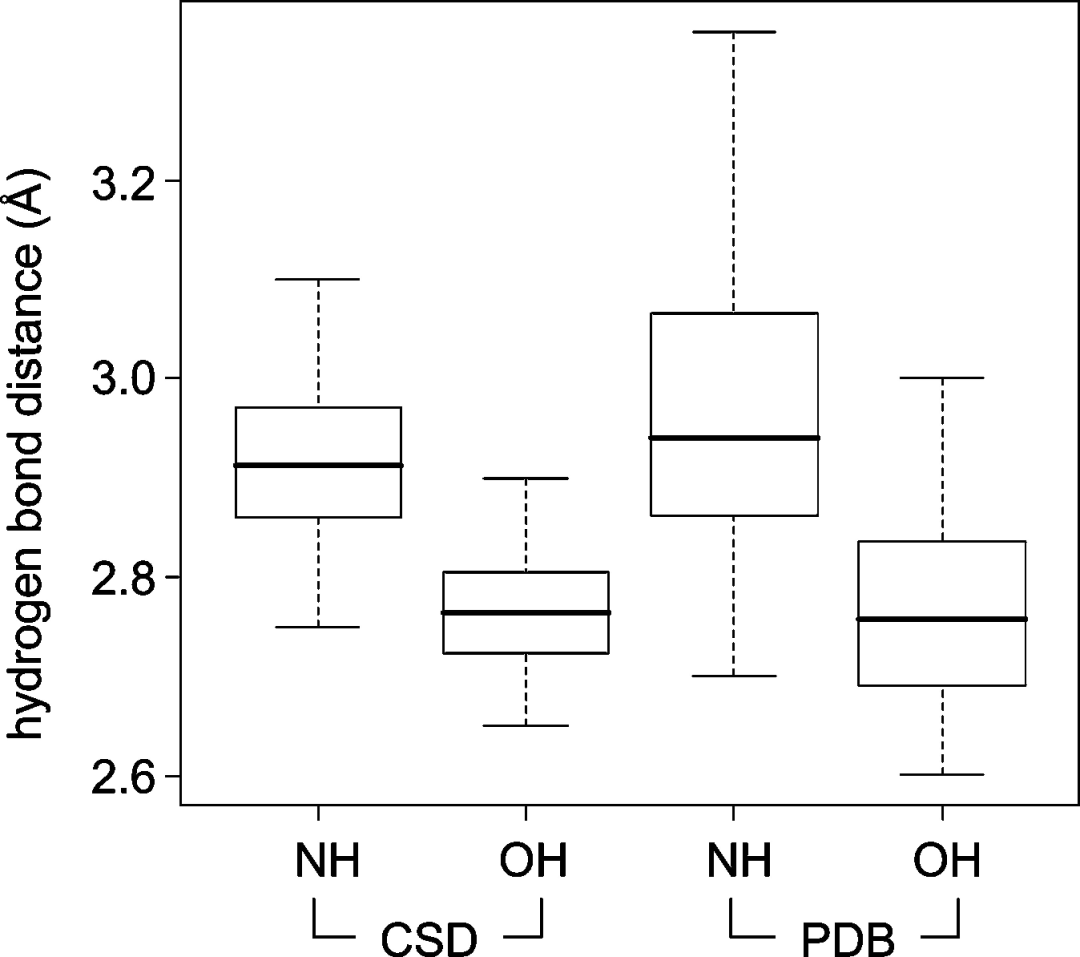
理论上,这意味着一个氢键应该在其观察到的中位距离的±0.1埃之内。如果在松弛状态下不能实现这一点,就应该修改设计。然而在实践中,这种严格的距离标准很少能被应用,因为蛋白结构对修改后的配体的适应性是难以预测的。此外,蛋白质结构的坐标精度比小分子晶体结构的坐标精度要低得多。
通过对CSD中的各种受体和供体的首选几何形状的分析,作者们发现即使是最弱的受体(乙醚、磺胺),中位距离也比供体和受体重原子的范德瓦尔斯半径之和短。带电的氢键比不带电的要短得多。例如,羧酸盐和铵之间的盐桥的中位距离为2.79埃,如果是中性的胺,这个距离增加到2.83埃。
另一篇发表于2017年的针对PDB数据库的挖掘分析显示N-H⋯O、N-H⋯N和O-H⋯O氢键中的重原子都有类似的中位距离,大约为3.0Å。这个数值比前面报道的酰胺C=O和OH/NH之间的氢键略高(高约0.1-0.2 Å)。个人认为这个差异是可以接受的,因为PDB中保存的结构模型在近几年急速增加,两篇文献所用的数据量不一样,或者分析方式不一样都可能带来结果的微小差异。
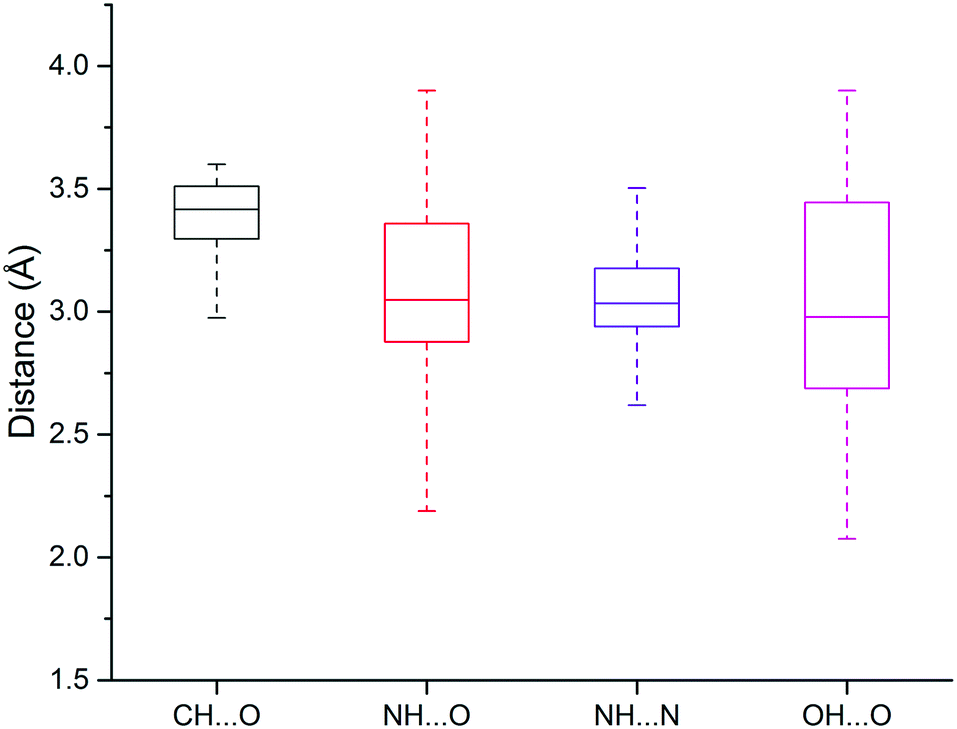
3.2 氢键的角度
氢键的角度偏好也是相当明显的。下图显示了一些典型的氢键几何形状。供体–氢–受体的角度通常在150°以上。只有醚这类相当弱的受体,这个角度有更大的变化。氢键通常沿着受体原子的自由电子对的方向形成。例如,C═O–H的角度分布峰值为120°,对应于羰基氧的孤对电子方向。
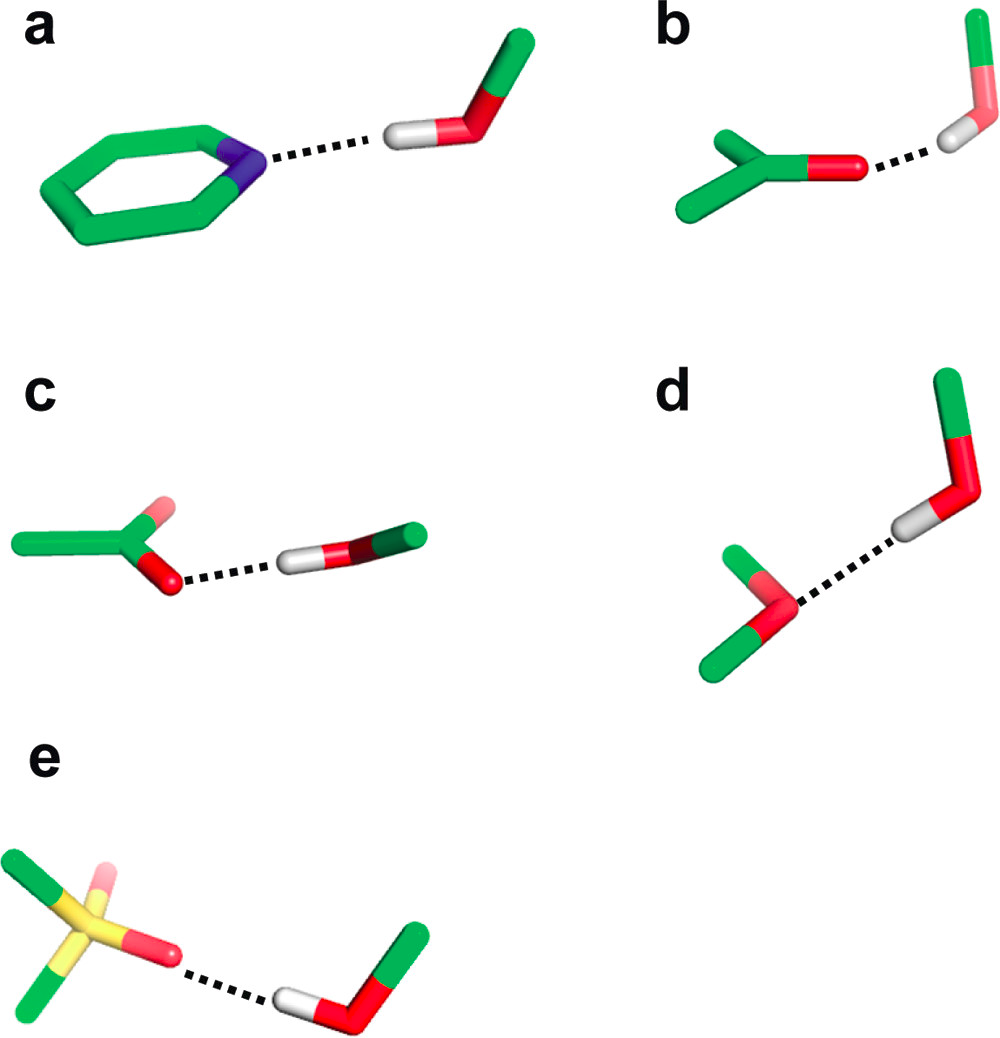
这个记忆法则对磺酰基不适用,在磺酰基中,沿S═O轴的氢键略为优先。对于磺酰基和羧基,需要进一步区分相对于第二个氧原子来说顺方向和反方向。这两种情况相比,顺方向比反方向更受欢迎。与顺方向孤对电子的相互作用几乎总是不对称的,供体原子只与其中一个氧原子相互作用。最后一个要监测的几何特征是在受体包含π系统(芳香环平面或由羰基及其两个取代原子形成的平面)的情况下,氢键与受体平面的偏差。与受体平面的偏差通常低于25-30°。
3.3 氢键的能量贡献
虽然定义哪些氢键的几何形状更受欢迎很容易,但它们对亲和力的贡献是高度依赖环境的。氢键对识别过程的特异性总是非常重要,但对于结合自由能的贡献并不总是很多 。因为形成氢键的时候,氢键供体和受体都必须发生去溶剂化,这样一来,去溶剂化和氢键形成带来的影响几乎互相抵消了。
因此,分子设计中的一个主要问题应该是需要让哪些供体和受体形成氢键,而不是如何形成更多的氢键。对蛋白-配体复合物结构的分析表明,NH和CO基团形成氢键的比例都非常大,特别是在高分辨率的晶体结构中。观察到的氢键数量明显地随着溶剂可及性的降低而增加。不满足蛋白质中的氢键供体,即把供体埋在去溶剂化状态中,比不满足受体有更严重的能量后果。Homas等人报告称,由于去溶剂化的代价,一个羟基结合在一个疏水口袋中的能量惩罚为4.3-5.3千卡/摩尔。而相对来说,丢失与骨架羰基的氢键时,自由能的损失很小。Bartlett和他的同事表明,用亚甲基取代NH几乎不会降低热溶酶的拟肽抑制剂的结合亲和力,而用氧取代NH会使亲和力急剧下降4千卡/摩尔。酰基化三肽及其类似物与万古霉素的结合也给出了类似的情况:用亚甲基取代NH导致结合自由能损失1.5千卡,用氧取代则损失4.1千卡/摩尔。在一系列Chk1抑制剂中,将吡咯环改为呋喃环时观察到结合亲和力减少1.4千卡/摩尔,在吡咯环和呋喃环这两种情况下,环上杂原子都指向Cys87骨架上的碳基。与前两个例子一样,这种亲和力的损失可能主要是由于引入了排斥性的O-O相互作用,而不是由于NH-O氢键的丢失。
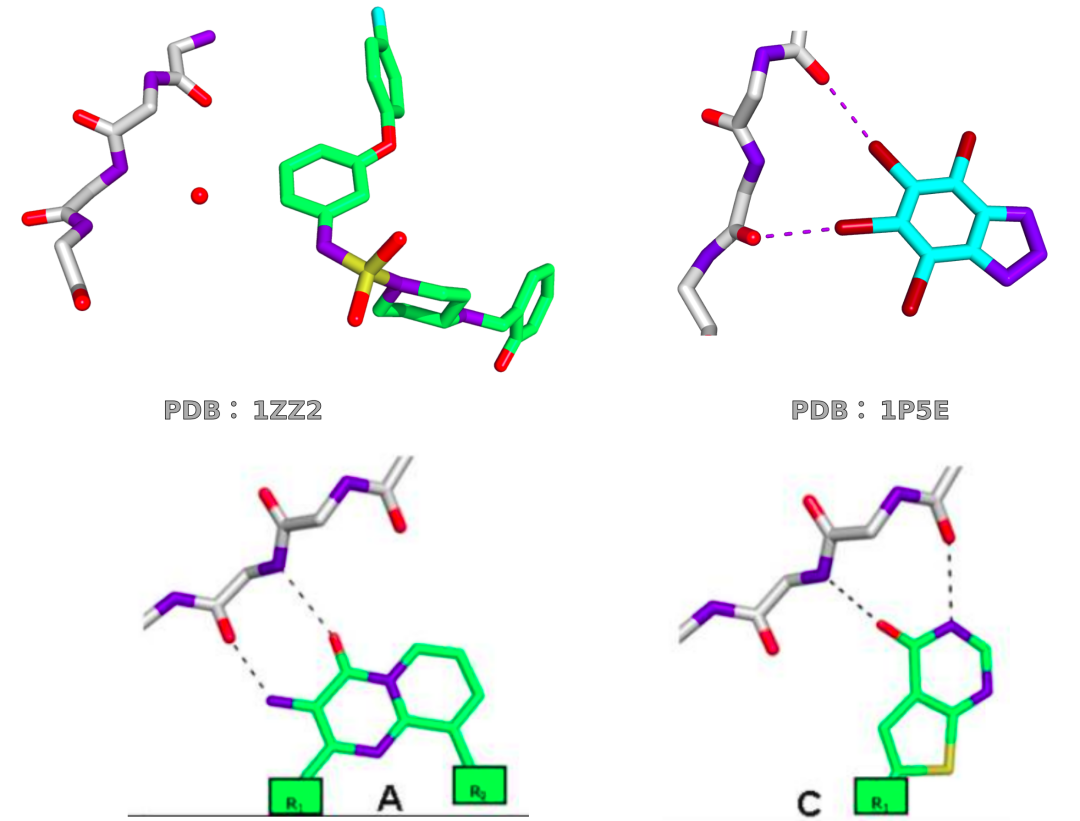
纵观激酶抑制剂,也证实了这一趋势。绝大多数具有直接铰链相互作用的激酶抑制剂都与位于铰链中心的骨架NH形成氢键。如果不形成氢键,骨干NH通常被溶解(见PDB 1ZZ2)。有一个配体的骨架NH没有形成氢键也没有被溶剂化,4,5,6,7-四溴苯三唑与侧翼骨架羰基形成两个卤素键,但与骨架NH没有直接的相互作用(PDB 1P5E)。相比之下,铰链区域结合配体往往有一个骨架羰基处于去溶剂化状态,没有补偿性的相互作用。
到目前为止,我们忽略了一个事实,即氢键的内在强度可以有相当大的变化。乍一看这可能是合理的,因为更强的氢键也意味着更高的去溶剂化成本,所以更强的氢键的净自由能增益可能是最小的。然而,这种情况过于简单化。就像溶剂可及性一样,氢键的几何形状和相邻原子的性质是决定这种自由能变化的关键参数;氢键的强度也应该被仔细评估。
Abraham通过实验确定了许多官能团形成氢键的倾向,Laurence则以pKBHX度量的形式确定并开发了pKBHX数据库。在没有实验数据的情况下,氢键受体强度可以通过量子化学计算得到。计算出的受体强度和从红外光谱中得到的强度通常有很好的相关性,这表明在水里氢键形成的熵成分在不同的受体中是相对恒定的。
从这些参数中可以学到什么?首先,受体强度与质子碱性没有直接关系。一个分子碱性最大的部分不一定是最好的氢键受体。因此,对受体强度的理解可以使我们更好地理解(例如复杂杂环的)去溶剂化效应和形成相互作用的倾向。其次,氢键受体(或供体)的强度与亲和力相关,对SAR研究有重要意义。最后,这些数值有助于设计具有更好整体特性的分子,例如,通过调节增溶基团的性质调节溶剂性。对CSD中氢键的分析也表明氢键形成的统计可能性与受体强度之间有一致性。例如,对CSD的分析发现芳香杂环中的氮受体比氧受体更常形成氢键,与pKBHX数据库的数据一致。
2010年的该篇CSD数据挖掘分析表明,氢键形成的频率和pKBHX受体强度之间也定性相关,如下表所示的无环氧原子氢键受体和一些平面杂环受体。除了官能团的性质外,许多因素影响氢键受体的强度。例如,环状酰胺(内酰胺)和环状醚的受体明显强于非环状的受体。芳香环上的给电子取代基会增加受体强度,而吸电子取代基会降低受体强度。芳香醚,如苯甲醚,是比脂肪族醚更弱的氢键受体。由于其形成氢键的倾向极低,二苯醚甚至可以被看作是二苯甲烷的生物电子等排体。
-|典型受体强度(pKBHX) | 与OH形成氢键的频率 [%]
| 非环氧原子受体 | - | - |
|---|---|---|
| 酰胺 | 2.2−2.6 | 48 |
| 酮 | 1.1−1.2 | 39 |
| 砜 | 1.1 | 37 |
| 磺酰胺 | 1.0 | 30 |
| 醚 | 1.0−1.2 | 16 |
| 平面杂环 | - | - |
| N-烷基化咪唑N | 2.72 | 41 |
| 吡啶N | 1.86 | 32 |
| 噁唑N | 1.67 | 30 |
| 吡嗪N | 0.92 | 25 |
| 呋喃O | −0.4 | 0.5 |
只有30%的砜和磺胺形成氢键,那到底这个官能团更喜欢哪种类型的相互作用?。2010年的这篇数据挖掘分析表示,在CSD中,大约80%的SO2基团与一个脂肪族碳原子距离相近(3.3-3.9Å)(作者在查询中,使用任意亚甲基单元-CH2-作为疏水性基团的原型)。在PDB中,配体中的磺酰基39%与蛋白质供体或结构水分子形成氢键,74%位于或接近蛋白脂肪族基团的范德瓦尔斯距离(3.3-3.9Å)处。值得注意的是,在PDB中位于疏水环境的磺酰基中,只有36%同时作为氢键受体进行相互作用,而79%成氢键的磺酰基被发现同时与一个疏水基团进行相互作用。这些发现清楚地表明,弱极性磺酰基具有作为氢键受体和疏水基团的双重特性。
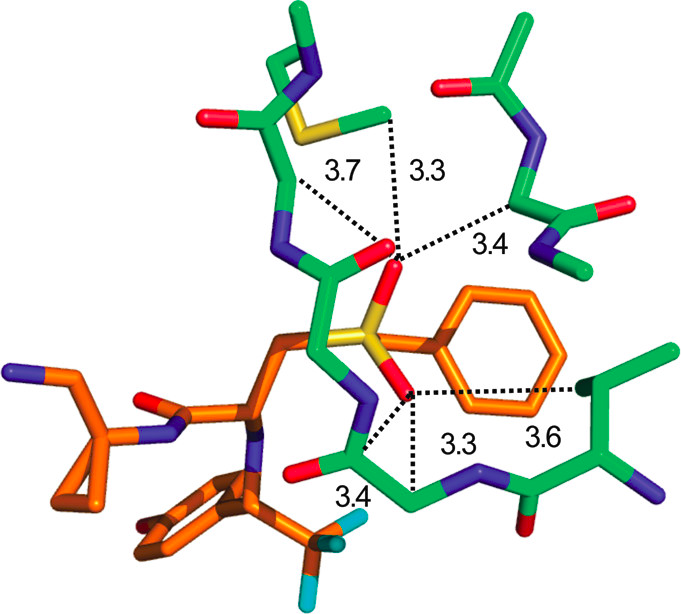
上图是磺酰基处于疏水环境的一个例子,它展示了配体CRA-27934和组织蛋白酶S共晶结构(PDB 2FRA)中结合部位的一部分。磺酰基与非极性原子形成若干范德瓦尔斯相互作用,并与Cα-H供体形成弱氢键。其他磺酰基处于疏水环境的例子包括FK506结合蛋白(PDB 1J4H)和苯乙醇胺N-甲基转移酶(PDB 2ONY)的复合物。磺酰基形成氢键在基质金属蛋白酶(PDB 3EHX)共晶结构中很突出。
关于氢键另一个需要药物设计者注意的点是:氢键很少是孤立的相互作用,而是受到附近其他极性原子的强烈影响。氢键可以在网络中相互加强。这可以在蛋白质二级结构中排列的氢键中观察到。一个受体形成多个氢键在蛋白-配体相互界面很常见,具有非最佳几何形状的氢键可以被额外的氢键作用伙伴所稳定,从而有助于满足总的氢键势。因此,在因其几何形状而将一个特定的相互作用标记为 “弱” 之前,我们应该评估其环境。重要的是学会从晶体结构分析中识别和前瞻性地应用更复杂的氢键模式。
参考资料
