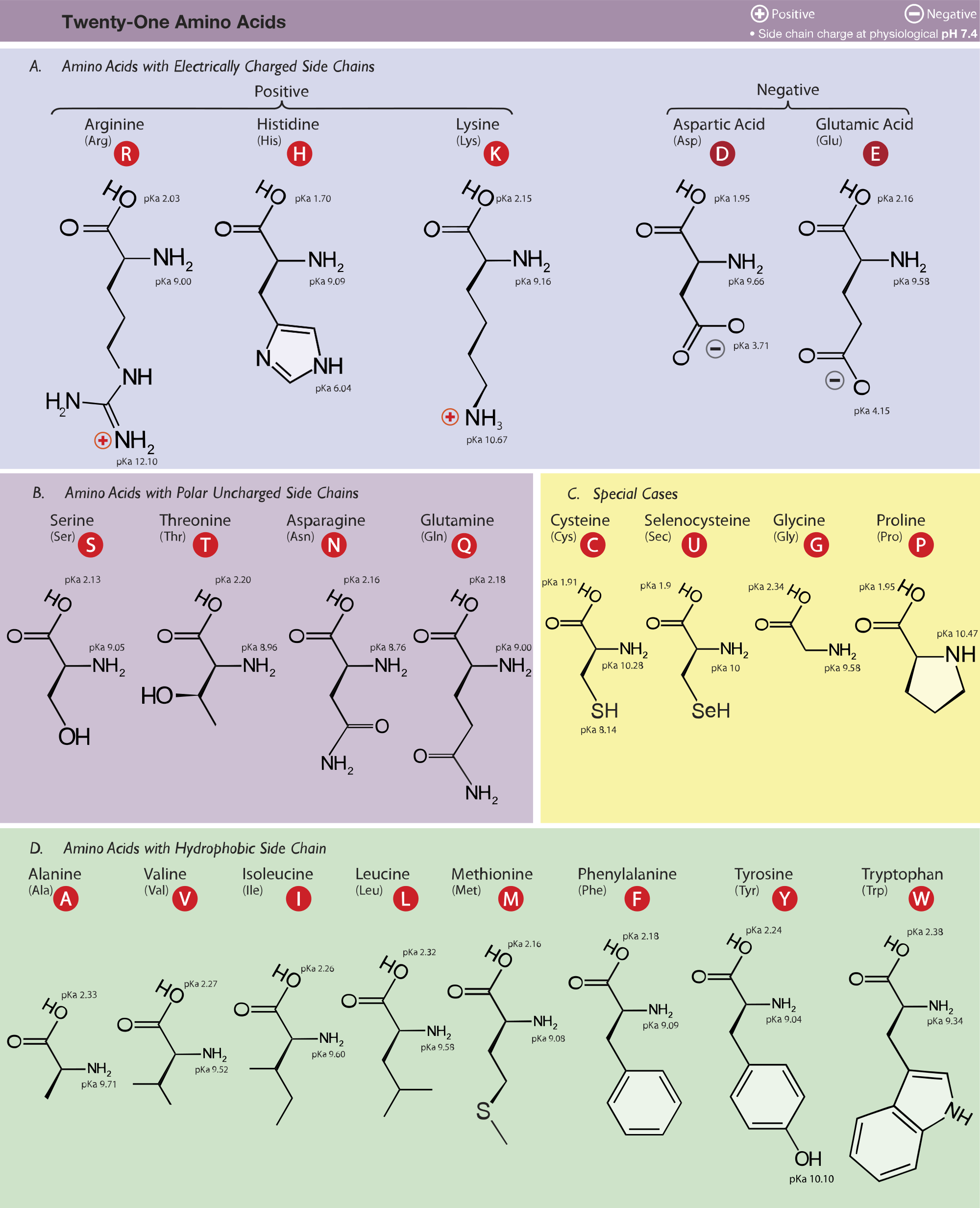
【1.1】氨基酸
一、基本概念
氨基酸是一类同时含有氨基和羧基的有机小分子物质。既有氨基又有羧基的特性,使得它们能够彼此缩合成肽,从而作为寡肽、多肽和蛋白质的组成单位。尽管自然界的氨基酸有300多种,既有D-型和L-型,又有α-型和β-型,但是组成蛋白质的氨基酸如果有旋光异构体的话,只能是L-型的α-氨基酸。氨基酸除了作为肽的组成单位以外,还是生物体内许多重要活性物质的前体,甚至某些氨基酸本身就具有特殊的生理活性。
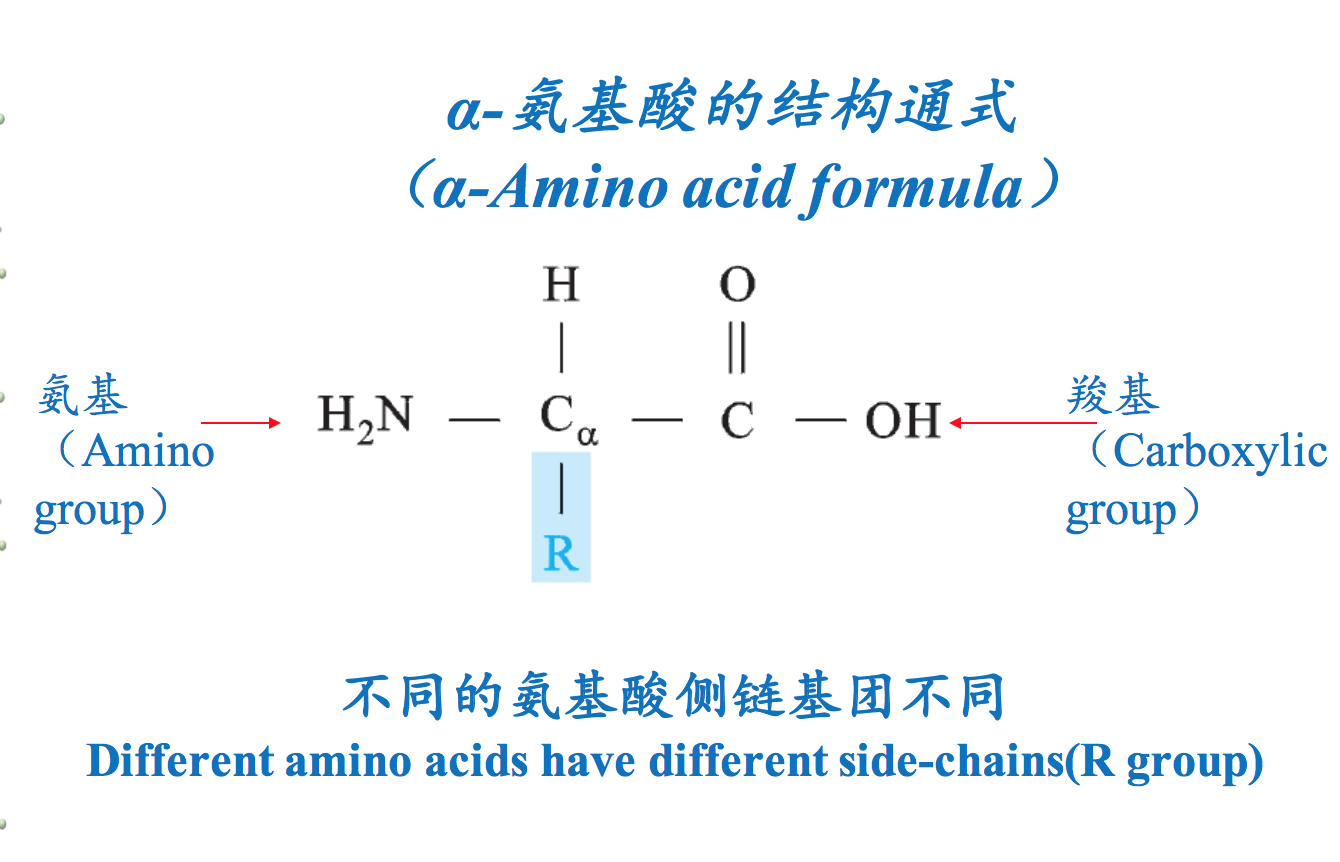
二、蛋白质氨基酸与非蛋白质氨基酸
自然界已发现有300种以上的氨基酸(More than 300 amino acids have been discovered in nature), 但只有22种在翻译的时候能够直接参入到蛋白质分子之中,这22种氨基酸称 为蛋白质氨基酸(but only 22 of them can be directly incorporated into proteins during translation and then are known as proteinogenic amino acids),其他所有的氨基酸都属于 非蛋白质氨基酸(the rest of them all belong to non-proteinogenic amino acids).
- 一种氨基酸要想在翻译的时候能够直接参入到蛋白质分子之中,必须先跟一种特定 的tRNA结合(Any amino acid has to be linked to specific tRNA before being introduced into the protein), 只有蛋白质氨基酸才有自己的tRNA( Only proteinogenic AAs have theirs own tRNAs)
- 20种常见(20 commonly found),所有的生物都需要(all organisms require the same set of 20), 由61个遗传密码子编码(encoded by 61 genetic codons).(The 20 amino acids that are encoded directly by the codons of the universal genetic code are called standard or canonical amino acids.)
- 2种比较罕见,一种是第21种即硒代半胱氨酸,另一种是第22种即吡咯赖氨酸(2 rarely found, one is the 21st amino acid-selenocysteine and the other is the 22nd amino acid- pyrrolysine).它们由两个终止密码子在特殊情况下编码(They are encoded by two stop codons under special conditions).


几种常见的非蛋白质氨基酸 (Non-protenogenic AA) 可以是天然的,也可能是蛋白质氨基酸的修饰产物(Can be naturally-occurring or chemical modifications of proteinogenic AA)
| Non-protenogenic AA (非蛋白质氨基酸) | 存在 (occurrence) |
|---|---|
| 瓜氨酸(citruline) | 尿素循环(the urea cycle) |
| 鸟氨酸(ornithine) 胱氨酸 (cystine) | 尿素循环(the urea cycle) 2个半胱氨酸的氧化产物(oxidative products two cysteines) |
| 羟脯氨酸(hydroxyl-proline) | 脯氨酸的羟基化产物(hydroxylating product of proline) |
| r-氨基丁酸(r-GABA) | 神经递质(neurotransmitter) |
三、疏水氨基酸与亲水氨基酸 (Hydrophobic & Hydrophilic AAs)
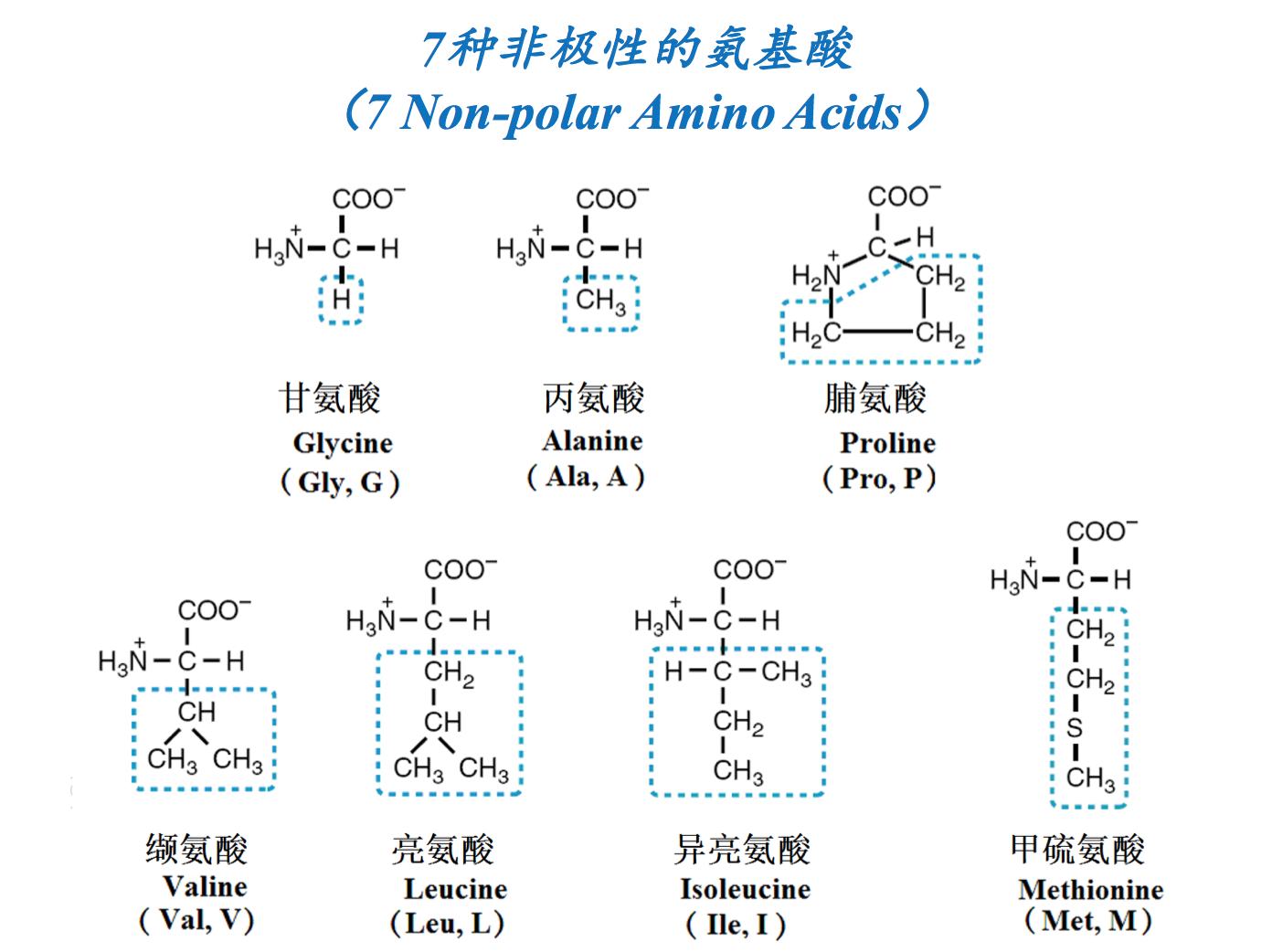
- 疏水氨基酸(侧链为非极性,不喜欢水)(Hydrophobic AA, with water-fearing and non-polar side chains): Gly, Ala, Val, Leu, Ile, Pro, Met, Phe, Trp
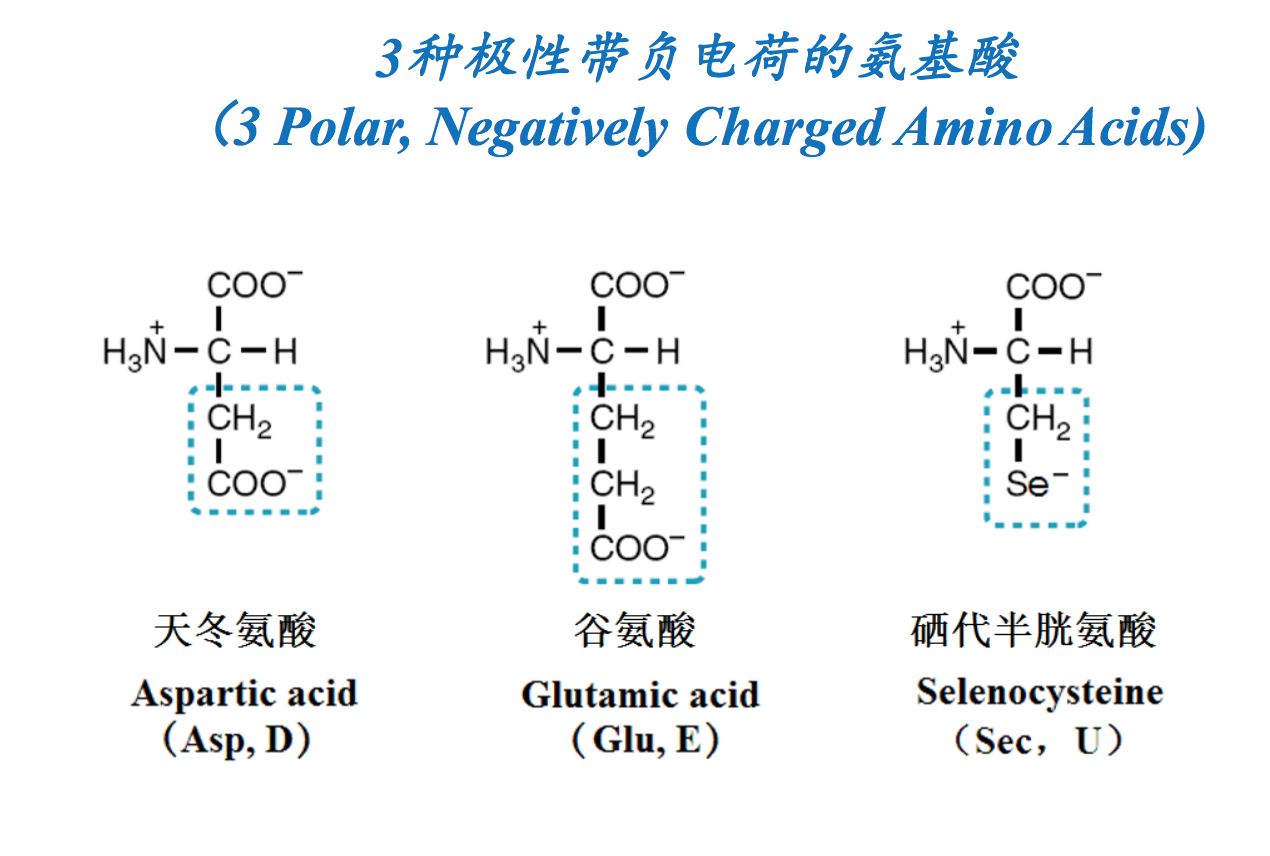
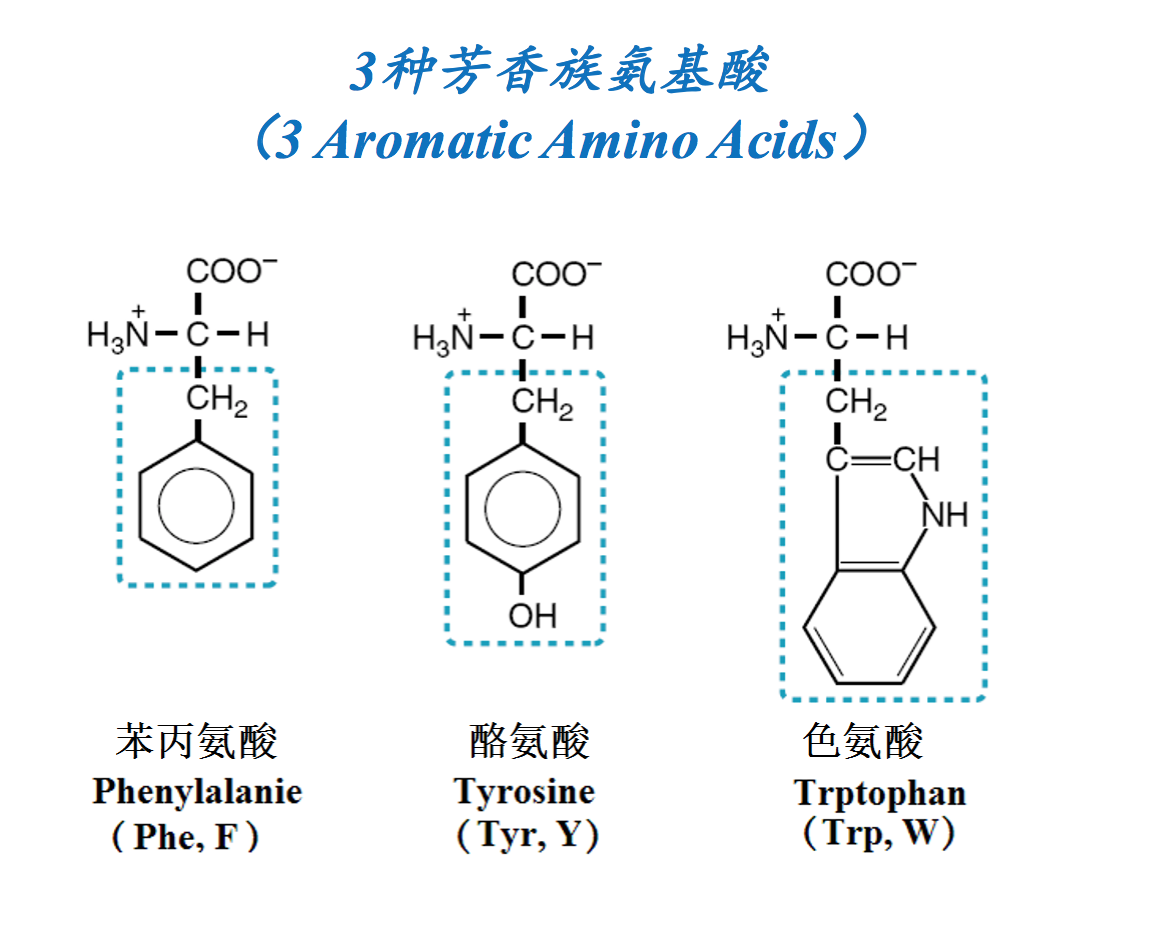
- 亲水氨基酸(侧链为极性,喜欢水)(HydrophilicAA, with water-loving and polar side chains): Ser, Thr, Tyr, Cys, Sec, Asn, Gln, Asp, Glu, Pyl, Arg, Lys, His
为什么我们必须记住一种氨基酸是疏水的还是亲水 的(Why do we have to memorize one amino acid is hydrophobic or hydrophilic?)
- 有助于理解蛋白质是如何折叠的以及蛋白质的三维结构是 如何稳定的(Help to understand how proteins are folded and their 3D structure can be stabilized)
- 有助于判断哪些氨基酸可以利用它们的侧链参与酶的催化 (Help to judge which amino acids can catalyze a reaction by their side chains)
- 有助于判断哪些氨基酸的侧链可以被化学修饰以调节酶活 性(Help to judge which amino acids can be chemically modified during regulating enzymatic activities)
- 有助于判断哪些氨基酸参与DNA和蛋白质之间的序列特异 性相互作用(Help to judge which amino acids are involved the base-sequence specific interaction between proteins and DNA)
Memorize the names of hydrophobic or hydrophilic AAs by Chinese poetry (词记亲水氨基酸与疏水氨基酸)
J 西湖景,紫竹为骨水潺潺 横笛相伴,闲听天籁静思禅 流苏落,心比双丝郁中缠
亲水氨基酸:西-硒代半胱氨酸;景-精氨酸;竹-组氨酸; 骨-谷氨酸 谷氨酰胺;伴-半胱氨酸;天-天冬氨酸 天冬酰胺;籁-赖氨酸;苏-苏氨酸;落-酪氨酸;比-吡咯 赖氨酸;丝-丝氨酸
J 孤雁本色,一行斜去浮生转 两鬓白,异家龙井难为甘
疏水氨基酸:本-苯丙氨酸;色-色氨酸;斜-缬氨酸;浮- 脯氨酸;两-亮氨酸;鬓-丙氨酸;异-异亮氨酸;家-甲硫 氨酸;甘-甘氨酸
四、必需与非必需氨基酸(Essential &Non-essentialAAs)
20种常见的氨基酸是所有生物体内的蛋白质合成所必需的(All 20 common amino acids are required for protein synthesis in all organisms), 但绝对多数动 物包括人体只能自己合成其中的12种(but most of the animals including the human body is able to synthesize only 12 of them). 其他8种只能从食物中获 取(The other 8 must be obtained from food), 这八种氨基酸称为必需氨基酸 (the essential amino acids),它们包括缬氨酸、异亮氨酸、亮氨酸、苯丙氨 酸、甲硫氨酸、色氨酸、苏氨酸和赖氨酸(which include valine , isoleucine, leucine, phenylalanine, methionine, tryptophan, threonine and lysine. 组氨酸和 精氨酸为半必需氨基酸,因为虽然可以合成,但在某些条件下还要从食物 补充(Histidine and arginine are called semi-essential amino acids because they are also required to be obtained from food under some conditions).
(中文谐音记必需氨基酸)
写一两本黄色书来: 写–缬氨酸;一–异亮氨酸;两–亮氨酸 ;本–苯 丙氨酸;黄–甲硫氨酸(黄牛);色–色氨酸;书- -苏氨酸;来–赖氨酸
五、氨基酸缩写
氨基酸残基和核酸的标准IUB/IUPAC缩写
| 单字母 | 三字母 | 英文 | 中文 |
|---|---|---|---|
| A | Ala | Alanine | 丙氨酸 |
| I | Ile | Isoleucine | 异亮氨酸 |
| R | Arg | Arginine | 精氨酸 |
| C | Cys | Cysteine | 半胱氨酸 |
| K | Lys | Lysine | 赖氨酸 |
| S | Ser | Serine | 丝氨酸 |
| D | Asp | Aspartic Acid | 天冬氨酸 |
| N | Asn | Asparagine | 天冬酰胺 |
| L | Leu | Leucine | 亮氨酸 |
| T | Thr | Threonine | 苏氨酸 |
| E | Glu | Glutamic Acid | 谷氨酸 |
| Q | Gln | Glutamine | 谷氨酰胺 |
| M | Met | Methionine | 甲硫氨酸 |
| V | Val | Valine | 缬氨酸 |
| F | Phe | Phenylalanine | 苯丙氨酸 |
| W | Trp | Tryptophan | 色氨酸 |
| G | Gly | Glycine | 甘氨酸 |
| P | Pro | Proline | 脯氨酸 |
| Y | Tyr | Tyrosine | 酪氨酸 |
| H | His | Histidine | 组氨酸 |
| X | Unk | 未指定或未知氨基酸 | |
| Z | Glx | Glutamine/Glutamic Acid | 谷氨酰胺/谷氨酸 |
| B | Asx | Asparagine/Aspartic Acid | 天冬酰胺/天冬氨酸 |
| U | Sec | Selenocysteine | 硒代半胱氨酸 |
| O | Pyl | Pyrrolysine | 吡咯赖氨酸 |
五、氨基酸的相似性

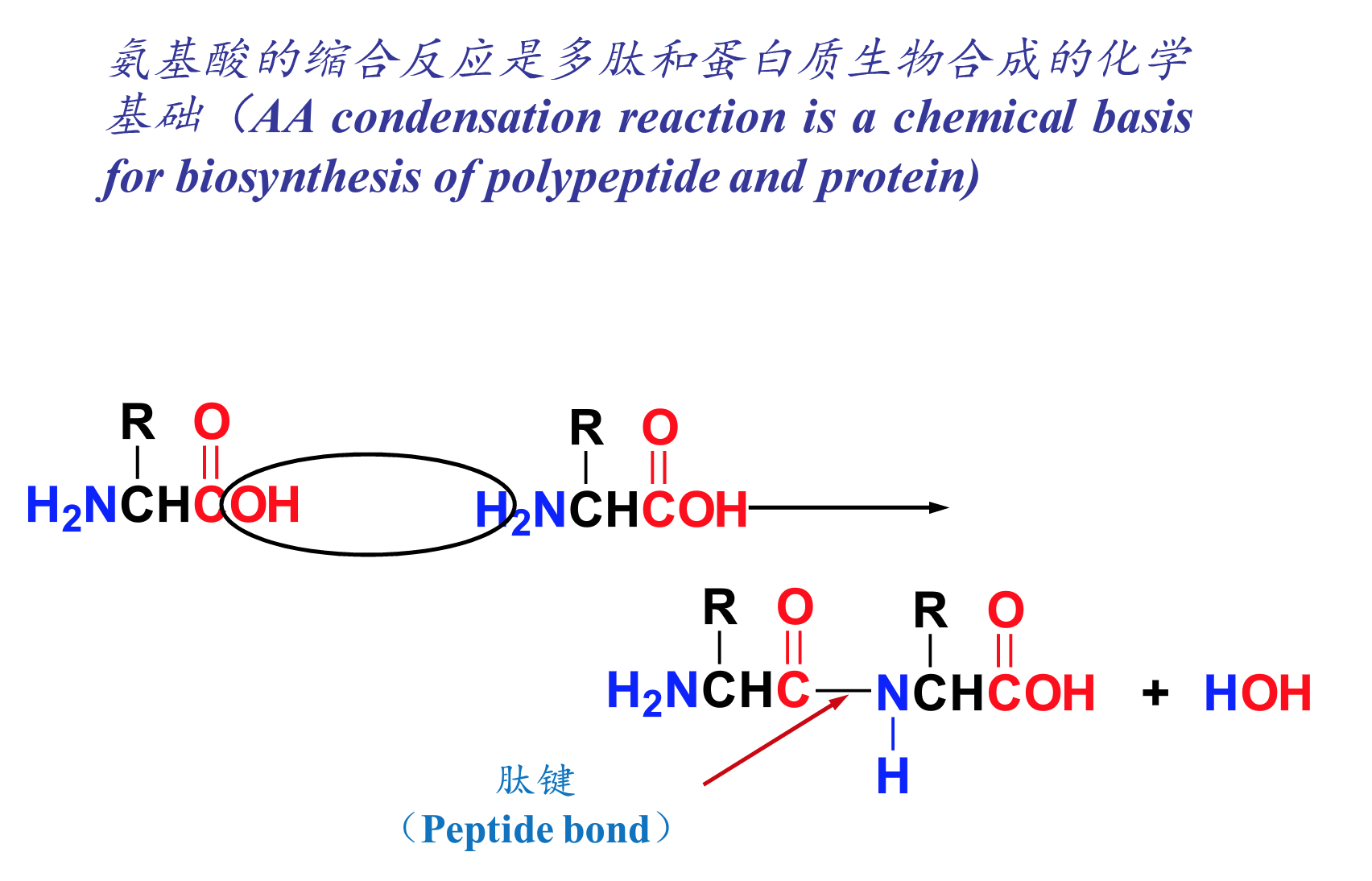
六、氨基酸的缩合和肽键的形成
七、氨基酸的手性(Chirality of Amino Acids)
- 含有手性碳的有机分子具有手性,具有手性的有机分子具有对映异构体或镜像 异构体,一个相当于我们的左手,另一个相当于我们的右手(Organic molecules with chiral carbon have chirality and therefore have a pair of enantiomers or mirror- images)。有手性的氨基酸可以对偏振光产生旋转,这一种性质叫旋光性,有仪器可以测定。
- 除了甘氨酸以外的所有氨基酸都具有手性,因此也具有对映异构体(Since all amino Acids but glycine are chiral molecules, it’s possible to have enantiomers).
- 由Fischer建立的基于DL系统的投影式,可以在平面上显示氨基酸的两种不同构 型的立体结构。在这个系统中,具有手性的甘油醛为参照物(A Fischer projection is used to differentiate between L- and D- molecules. On a Fischer projection, the D- glyceraldehyde is depicted with hydrogen on the left and hydroxyl on the right. The reverse is L-glyceraldehyde. In the case of amino acids, the D-amino acids are depicted with hydrogen on the left and amino on the right. The reverse are L-amino acids).
- 然而,自然界的氨基酸主要是L型,蛋白质里面的氨基酸只能是L型(However, L-amino acids predominate in nature and proteins only use L-amino acids)。可能跟tRNA的反应的酶有关。
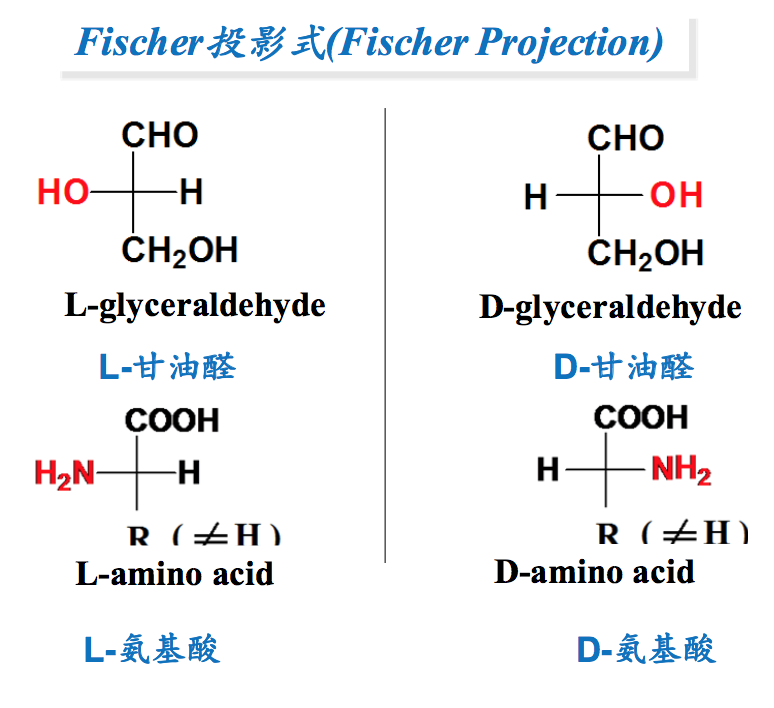
除了甘氨酸,其余氨基酸均至少含有一个不对称碳原子(Thr和Ile有两个手性碳),因此都具有手性(chirality)。如果以L型甘油醛和D型甘油醛为参照物,具有不对称碳原子的氨基酸就有L型和D型两种对映异构体(enantiomer)或镜像异构体。实验证明,蛋白质分子中的不对称氨基酸都是L型。D型氨基酸仅存在于一些特殊的抗菌肽(如短杆菌肽)和细菌细胞壁的主要成分——肽聚糖之中,它们不能参入到在核糖体上合成的多肽或蛋白质分子之中。
必须指出的是,氨基酸的D型和L型与氨基酸的旋光方向没有必然的联系,也就是说,某些L型氨基酸使偏振光的振动方向顺时针旋转(正值),而另一些则是逆时针旋转(负值)。一种氨基酸的旋光方向需要通过实验(旋光仪)来测定。
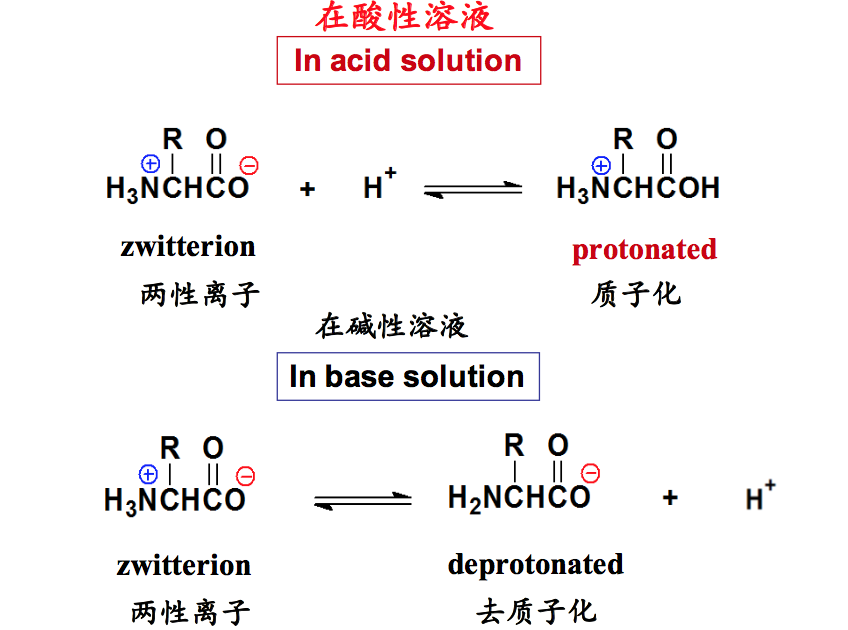
八、氨基酸的两性解离
氨基酸由于同时含有碱性的氨基和酸性的羧基,因此具有特殊的解离性质,但一种氨基酸的碱性和酸性分别弱于单纯的胺和羧酸。一个氨基酸分子内部的酸碱反应使氨基酸能同时带有正负两种电荷,以这种形式存在的离子称为两性离子或兼性离子。
如果将R基团考虑进去,那么有十种蛋白质氨基酸的R基团具有解离的性质,这些R基团是否解离可直接影响到这十种氨基酸的带电状态。然而,对于任何一种氨基酸来说,总存在一定的pH值,使其净电荷为零,这时的pH值称为等电点(pI)。
两性离子与等电点(Zwitterions and pI)
- 两性离子就是具有双极性的离子(A zwitterion is a dipolar ion).
- 氨基酸同时带有碱性的氨基和酸性的羧基,所以就具有两性解离的性 质,即可以以两性离子的形式存在(Amino acids are zwitterions, since they contain an amino group and a carboxylic group which can undergo an internal acid-base reaction).
- 此外,肽、蛋白质、核苷酸和核酸也能够以两性离子的形式存在 (Besides, peptides, proteins, nucleotides and nucleic acids also can exist in zwitterions)
- 具有两性解离性质的分子就具有等电点。等电点是一个特殊的pH,在 这个pH下相应的两性解离分子所带有的净电荷刚好是0(The molecule with acid-base disassociation has a special pH, or isoelectric point- pI, at which its net charge is exactly zero).
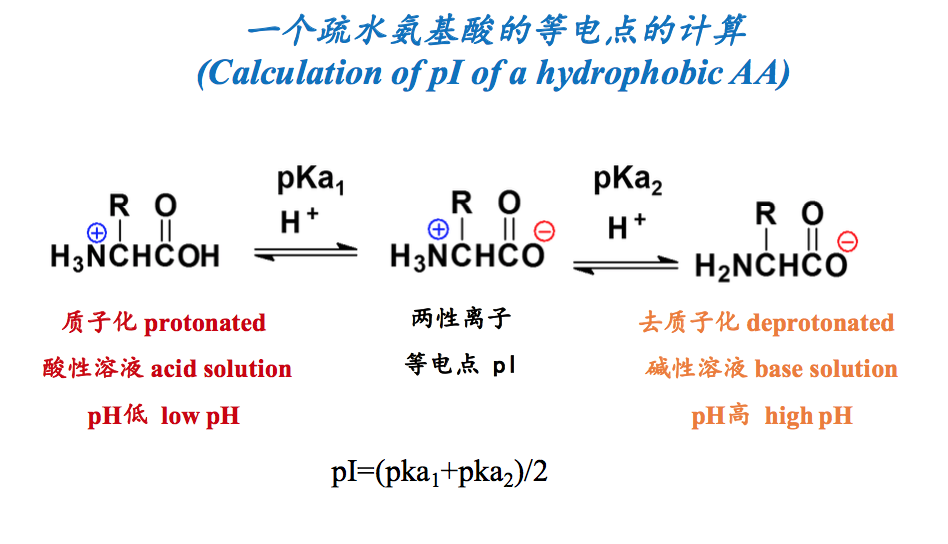
pI是一种氨基酸的特征常数。当一种氨基酸处于pH= pI的溶液中,这种氨基酸绝大多数处于两性离子状态,少数可能解离成阳离子和阴离子,但解离成阴、阳离子的趋势和数目相等,由于所带的净电荷为0,因而若处在电场中,则不会向两极移动。利用上述性质,很容易推导出各种氨基酸pI的计算公式,也可以使用酸、碱滴定的方法直接测出各种氨基酸的pI值。
如何确定一种氨基酸的等电点
- 实验测定-滴定(By experiment-titration)
- 计算(By calculation): 对于仅含有2个pKa的氨基酸来说,pI就是这两个pKa的算术平均值; 对于含有3个pKa的氨基酸来说,将净电荷为0的哪一种形式两侧的2个 pKa找出来,然后再算一下它们的算术平均值(In the case of amino acids with only two pKa, just average two pKa; In the case amino acids with three pKa, just find two pka around the zwiterrion with zero net charge and average them).
计算一种氨基酸的pI的具体步骤是:
(1)找出这种氨基酸的所有可解离基团,并注明它们各自的pKa;(2)假定将它放在极低的pH下,这时它所有的可解离基团都处于非解离的质子化状态;(3)逐步提高溶液的pH,可解离基团按照pKa从低到高的顺序依次释放出质子,即pKa越低的就越先释放出质子;(4)写出所以可能的解离形式,并找出净电荷为0的形式;(5)将净电荷为0形式两侧的pKa相加除以2。根据上述计算的方法,不难得出:对于只含有两个pKa的即侧链上无可解离基团的氨基酸(A、F、G、I、L、M、N、P、Q、V、W)而言,它们的pI是将两个pKa相加除以2,对于两个酸性氨基酸(D和E)而言,是将两个最低的pKa相加除以2,而对于三个碱性氨基酸(H、K、R)而言,是将两个最高的pKa相加除以2。

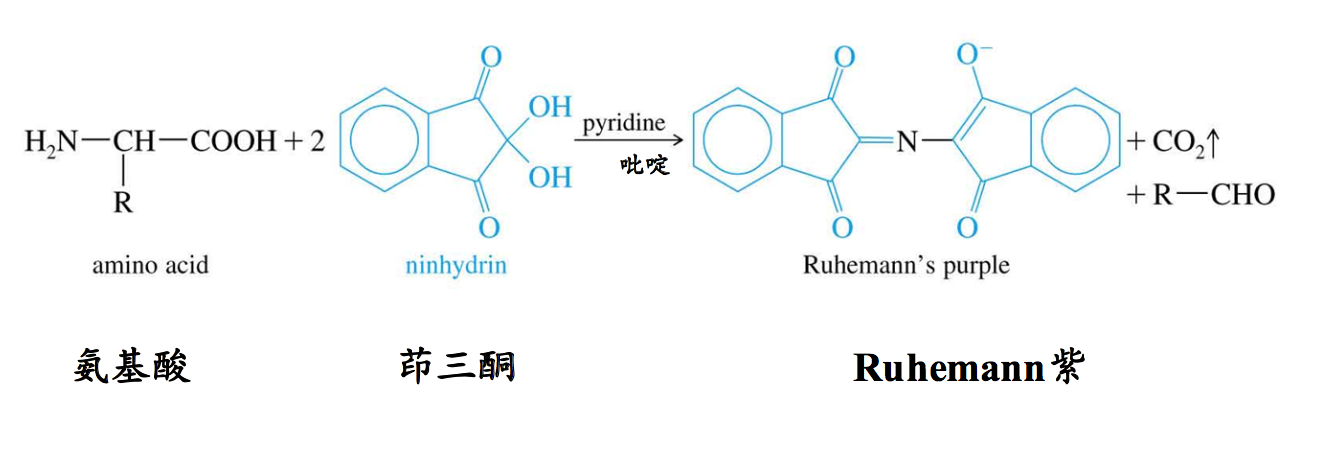
九、茚三酮反应(Reaction with Ninhydrin)
氨基酸与水合茚三酮一起在水溶液中加热,可发生反应,生成蓝紫色物质,此反应被称为茚三酮反应。所有的氨基酸以及具有游离α-氨基和α-羧基的肽和蛋白质都与茚三酮起反应,并产生蓝紫色物质,只有脯氨酸和它的修饰产物(羟脯氨酸)与茚三酮反应产生黄色物质。
- 用于观察由层析或电泳分离开的氨基酸斑点和或条带(Used to visualize spots or bands of amino acids separated by chromatography or electrophoresis).
- 反应产物呈深蓝紫色,脯氨酸例外,为黄色(Deep purple color formed with traces of any amino acid except Pro is yellow).
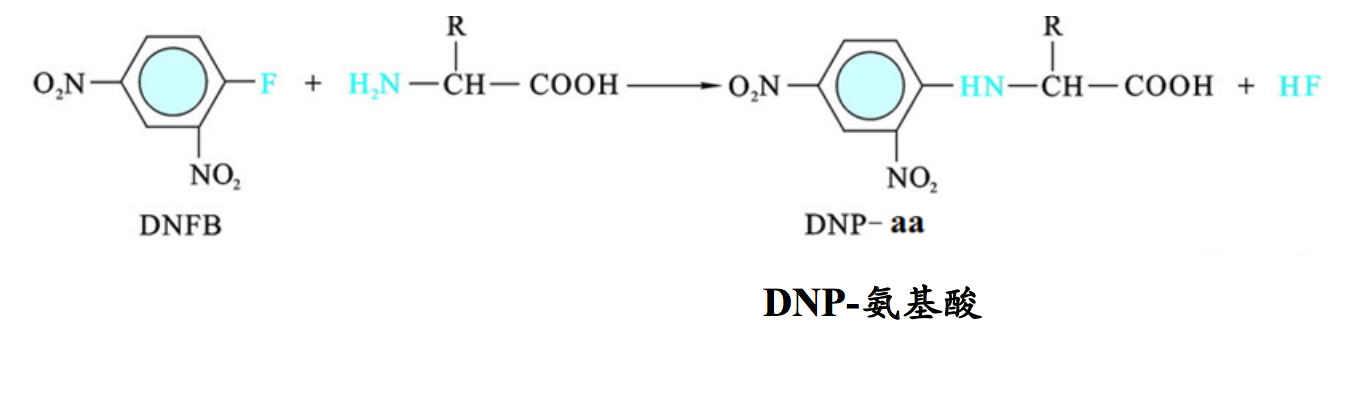
十、Sanger反应(Reaction with DNFB)
在弱碱性溶液中,氨基酸的α-氨基很容易与2,4-二硝基氟苯(2,4-dinitrofluorobenzene,DNFB)起反应,生成稳定的黄色物质——2,4-二硝基苯氨基酸(DNP-氨基酸)。此反应最初由Frederick Sanger发现,因此也叫Sanger反应,而DNFB也称为Sanger试剂。
多肽或蛋白质在N-端游离的α-氨基也能与DNFB反应,但生成的是DNP-多肽或DNP-蛋白质。由于DNP与氨基结合牢固,不易被水解,因此当DNP-多肽被酸完全水解以后,原来的N-端氨基酸成为黄色的DNP-氨基酸。因为DNP-氨基酸溶于乙酸乙酯或乙醚等有机溶剂,所以可以用这两种试剂对其进行抽提,随后进行色谱分析,并以标准的DNP-氨基酸作为对照,就可以鉴定出此氨基酸的种类。Sanger当初就是使用上述方法,测出胰岛素两条链在N-端的氨基酸。现在仍然有人使用他发明的方法,来鉴定多肽或蛋白质的N-端氨基酸。
- Sanger反应涉及到Sanger试剂,即2,4-二硝基氟苯(Sanger reaction involves Sanger’s reagent or dinitrofluorobenzene or DNFB)
- DNFB与游离的氨基酸的氨基或者与蛋白质N端游离的氨基反应,产生 DNP氨基酸。DNP氨基酸在温和水解肽键的条件下稳定,因此可用来 鉴定蛋白质N端的氨基酸(Dinitrofluorobenzene reacts with the amine group in amino acids or the amino group on the N-end of proteins to produce dinitrophenyl-amino acids. These DNP-amino acids are moderately stable under acid hydrolysis conditions that break peptide bonds. The DNP- amino acids can then be recovered and identified).
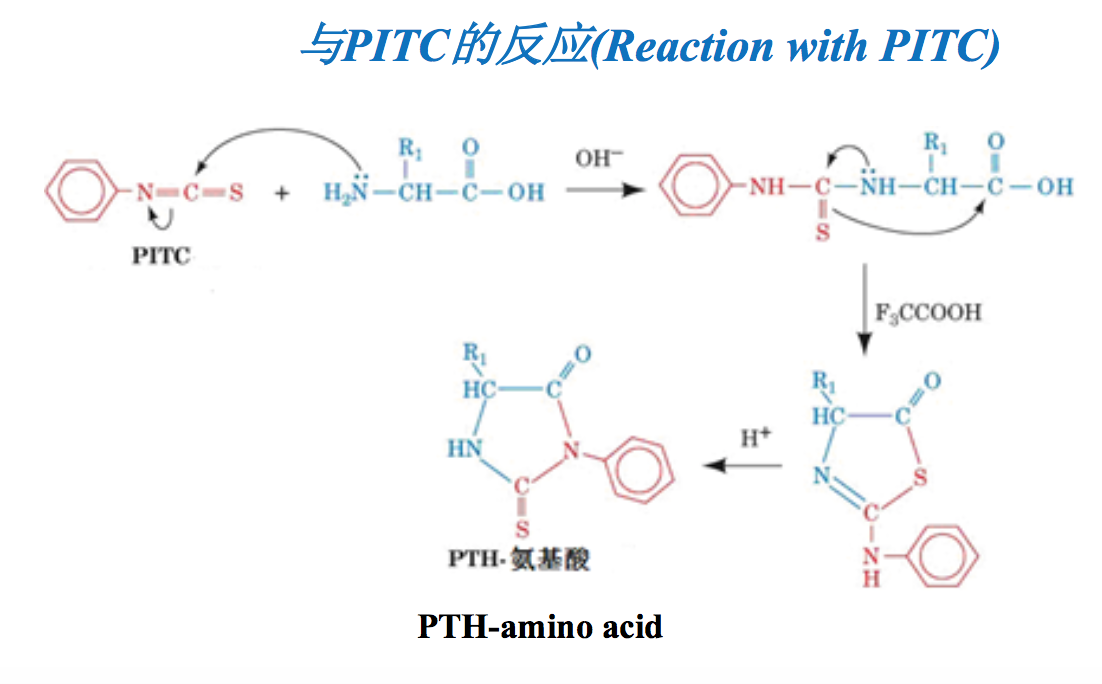
十一、Edman降解(Edman degradation)
在弱碱性条件下,氨基酸的α-氨基可与苯异硫氰酸酯(phenylisothiocyanate, PITC)反应,生成相应的苯氨基硫甲酰氨基酸(PTC-氨基酸)。在酸性条件下,PTC-氨基酸会迅速环化,形成稳定的苯乙内酰硫脲氨基酸(PTH-氨基酸)。
多肽链N-端氨基酸的α-氨基如果没有被封闭,例如甲酰化修饰,那么也能发生此反应,生成PTC-肽。在酸性溶液中,PTC-肽会释放出末端的PTH-氨基酸,而产生比原来少1个氨基酸残基的肽链。新暴露出来的N-端氨基可再次进行同样的反应。经过多次重复,N-端的氨基酸依次释放出来,成为PTH-氨基酸。由于PTH-氨基酸在酸性条件下极稳定,并可溶于乙酸乙酯,因此在每一次反应结束以后用乙酸乙酯抽提,再经高压液相层析,就可以确定肽链N-端氨基酸的种类,并逐步确定出一个完整的多肽链上的氨基酸顺序。氨基酸自动顺序分析仪就是根据该反应原理而设计的。
- 在弱碱性条件下,氨基酸的氨基可与苯异硫氰酸酯反应,生成相应的苯氨基 硫甲酰氨基酸,即PTC-氨基酸。在酸性条件下,PTC-氨基酸会迅速环化, 形成稳定的苯乙内酰硫脲氨基酸,即PTH氨基酸(Phenylisothiocyanate or PITC reacts with amino groups from amino acids under mildly alkaline conditions, to form a cyclical phenylthiocarbamoyl derivative. Then, under acidic conditions, this derivative can be converted into the more stable phenylthiohydantoin–amino acid, or PTH-amino acid)
- 多肽链N端氨基酸的氨基也能发生此反应,而且可以重复进行,从而可以确 定氨基酸的排列顺序 (Free N-terminal amino groups also react with PITC. And this procedure can then be repeated again and again to identify the sequence of amino acids).
十二、氨基酸密码子表
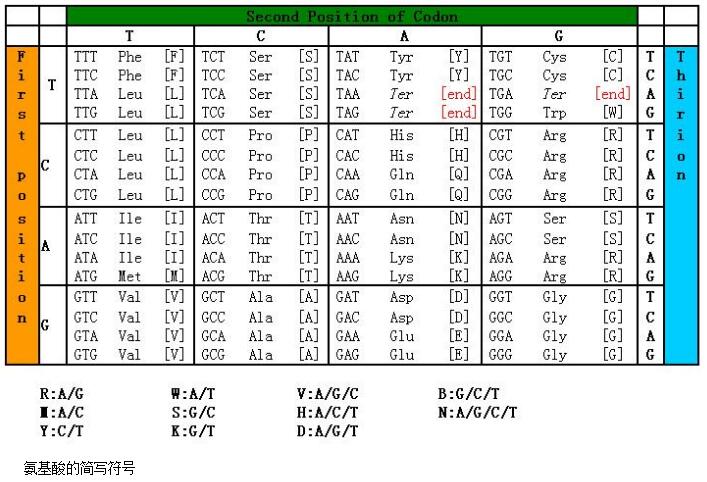
参考资料
