【4.4】在实验中使用 FRET 的技巧
众所周知的FRET,又名荧光 (Förster) 共振能量转移( Fluorescence Resonance Energy Transfer),该技术允许原位检测分子的相互作用、修饰或解离。自 90 年代中期以来,这项技术已经彻底改变了我们理解分子复合物的方式,并且仍然是一个非常有用的工具。
事实上,FRET 是最早能够使用显微镜测量活细胞中单分子相互作用的技术之一。从历史上看,分子相互作用是通过间接方式检测的,通常使用具有靶向多种分子的潜力的探针。打个比方,这就像在大学礼堂里指着一群学生,但不知道这些学生是否认识或互动。FRET 降低了我们对分子相互作用的看法。
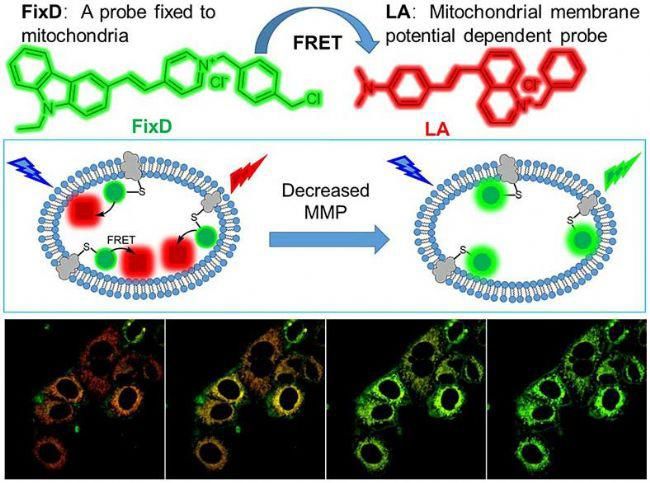
基于两个荧光基团间能量通过偶极-偶极耦合作用以非辐射方式从供体传递给受体的现象,可用于测定分子间的距离。在两个不同的荧光基团中,如果一个荧光基团(供体 Donor)的发射光谱与另一个基团(受体 Acceptor)的吸收光谱有一定的重叠,当这两个荧光基团间的距离合适时(一般小于100A),就可观察到荧光能量由供体向受体转移的现象,即以前一种基团的激发波长激发时,可观察到后一个基团发射的荧光。
优点:
① 适用于活细胞和固定细胞的各类分子,
② 灵敏度更高,成像更清晰,最直观地提供蛋白质相互作用的定位和定量信息。
缺点:
① 能量供体与能量受体的光谱、排列方式、量子产率、消光系数、水溶性、抗干扰能力等方面要求较高。
② 需要更加精密的仪器,技术难度更高,操作更复杂。
什么是 FRET?
在他们的JCB 2003 论文中,Sekar 和 Periasamy 将 FRET 定义为“一种依赖于距离的物理过程,通过该过程,能量通过分子间长程偶极-偶极耦合以非辐射方式从激发的分子荧光团(供体)转移到另一个荧光团(受体)。” 可以使用显微技术测量受体荧光团的发射。FRET 测量灵敏度使其适用于研究活细胞内的相互作用。通过将荧光团与蛋白质偶联,这项技术的先驱能够直接检测活细胞中的蛋白质/蛋白质相互作用。从那时起,FRET 也被用于测量构象变化、使用基于 FRET 的生物传感器的切割活性,以及 DNA和蛋白质之间的相互作用。理论上,FRET 是一种简单的技术,但遵循一些简单的规则以避免常见的陷阱并发挥其最佳作用非常重要。
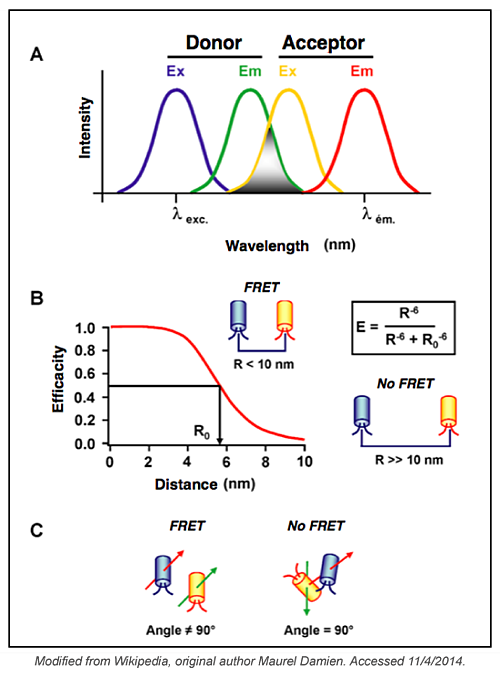
影响 FRET 的参数有哪些?
当使用的两个荧光团靠近时会发生 FRET。因此,两个荧光团之间 的距离及其彼此的方向会影响 FRET。在研究两种蛋白质之间未知的相互作用时,这些参数很难克服,但在分析 FRET 实验数据时必须考虑这些参数。您可能需要设计几种不同的结构才能找到一种可用于研究目的的结构。在设计生物传感器时,这些参数不太重要,因为两个荧光团之间的距离及其空间方向将是固定的。
供体的量子产率(每个吸收光子的发射光子数)和受体的消光系数(将给定波长下吸收的光量与溶液中荧光团的浓度联系起来)是两个额外的参数,可以影响FRET 效率。这些问题可以通过选择一对互补的荧光团来克服 。为了最大化 FRET 信号,您应该选择最高的量子产率供体、最高吸收受体和在其光谱中有显着重叠的荧光团。CFP-YFP 对是第一个用于研究蛋白质-蛋白质相互作用的对,此后还使用了其他几个对,包括: mCerulean / mVenus,mCerulean / Amber、mCerulean / SYFP2A、mTurquoise / mVenus等。CFP-YFP 仍然是测量 FRET 的最佳和最常用的对之一。
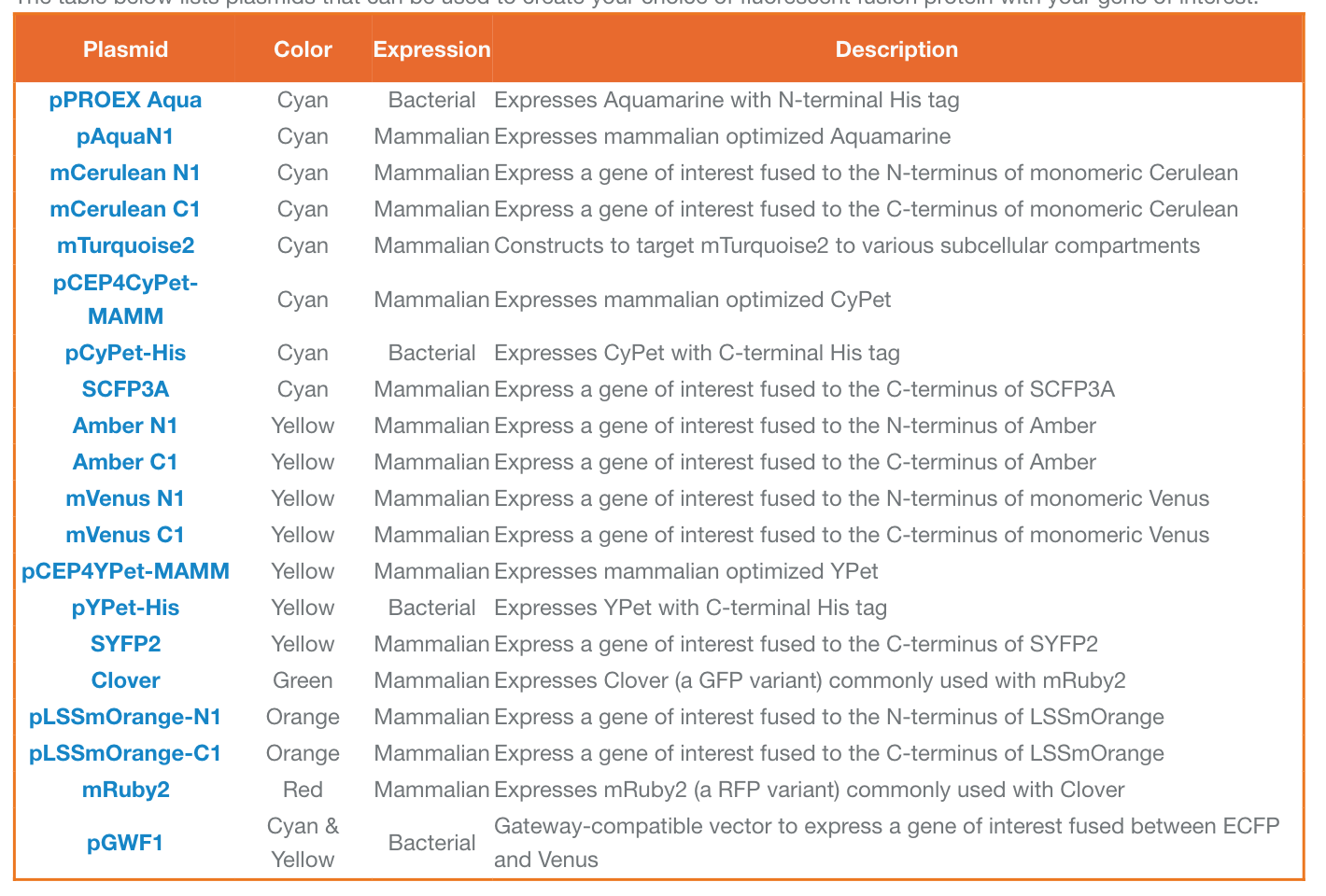
下表列出了可用于创建您选择的荧光融合蛋白与您感兴趣的基因的质粒:
可能影响 FRET 测量的其他问题包括:荧光团对的亮度、供体:受体化学计量以及两种荧光团颜色之间的串扰。FRET 专家建议使用两种亮度相似的荧光团 - 即使在最受欢迎的一对中,CFP 的亮度比 YFP 低五倍。供体:受体的化学计量很难解决,尤其是当您研究未知的分子复合物时。但这是一个在分析 FRET 结果时必须牢记的参数。两个荧光团之间的串扰与其激发光谱重叠有关。如果您选择在光谱中彼此太近的一对,您可以轻松地使用用于激发供体的激光直接激发受体。在这种情况下,串扰很高,您的背景信号可能高于能量转移产生的信号。相反,如果您选择彼此相距太远的一对,则没有任何串扰,但也没有任何共振转移。您必须在 FRET 效率和串扰之间找到平衡。
在细胞生物学研究中测量 FRET 的方法
在过去的 20 年中 ,已经使用了多种方法来测量 FRET,并且没有一种方法比另一种方法更好。FRET 专家通常建议在首次开始为给定实验建立 FRET 方法时使用尽可能多的测量方法。然后,您可以为自己的系统选择最有效的方法。
最简单和最流行的方法是敏化发射方法,其中供体被特定波长的光激发,并通过使用为供体荧光和受体荧光选择的发射滤光片收集信号。此外,如果 FRET 对之间没有串扰,则此方法可能是最佳选择。不幸的是,现实世界中确实存在荧光团之间的串扰,并且需要纠正方法和适当的控制 来使这种 方法适用于 FRET 变化很大的动态实验。
其他两种方法通常用于测量 FRET :受体光漂白法和荧光寿命成像显微镜 (FLIM, fluorescence lifetime imaging microscopy) 法。
受体光漂白法: Acceptor photobleaching method
受体光漂白方法很简单,但仅限于单次测量。该方法基于当 FRET 发生时供体被淬灭的事实。通过对受体进行光漂白,您可以释放供体的淬灭,并增强供体的荧光。这种方法简单、定量,但具有破坏性,不能用于动态测量。应格外小心,以免破坏供体分子。
荧光寿命成像显微法: Fluorescence lifetime imaging microscopy method
FLIM 是最近开发的,是测量 FRET 的最严格的方法。FLIM 测量供体的荧光衰减时间。当成对之间发生 FRET 时,供体荧光被淬灭,供体的荧光衰减时间缩短,从而使 FLIM 能够给出明确的 FRET 效率值。由于您不测量受体荧光,因此该方法对直接受体激发伪影也不太敏感,并且可以使用非荧光受体。应该指出的是,FLIM 是一种较慢的成像方法,限制了它在许多 FRET 实验中的使用。此外,其他环境因素,如 pH 值或自发荧光背景,可以改变荧光衰减时间,在解释数据时必须考虑在内。
FRET 已经有 20 年的历史了,但你可以想象它一点也不老式。随着新荧光对的发展和更快的测量系统的出现,这项技术仍有许多美好的日子和良好的“演出”……不要冒犯 BRET、CRET 和其他从未超越 Master 的 RET 技术
备注
BRET= Bioluminescence Resonance Energy Transfer 生物发光共振能量转移
CRET= Chemiluminescence Resonance Energy Transfer 化学发光共振能量转移
参考资料
