【7.3.2】菌落 PCR
分子克隆需要一些筛选菌落是否存在插入物的方法。传统上这是通过限制性内切酶消化完成的;然而,菌落 PCR 可以用更少的时间和更少的钱完成同样的事情。菌落 PCR 的关键步骤是:1) 设计引物以检测插入片段的存在;2)以裂解菌的上清液为模板,建立标准PCR反应(引物、dNTPs、聚合酶);和 3)在凝胶上运行 PCR 产物以分析产物大小。这篇博文讨论了进行菌落 PCR 时需要考虑的一些关键事项。
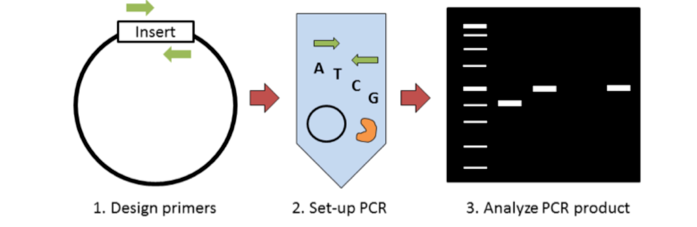
设计菌落 PCR 引物
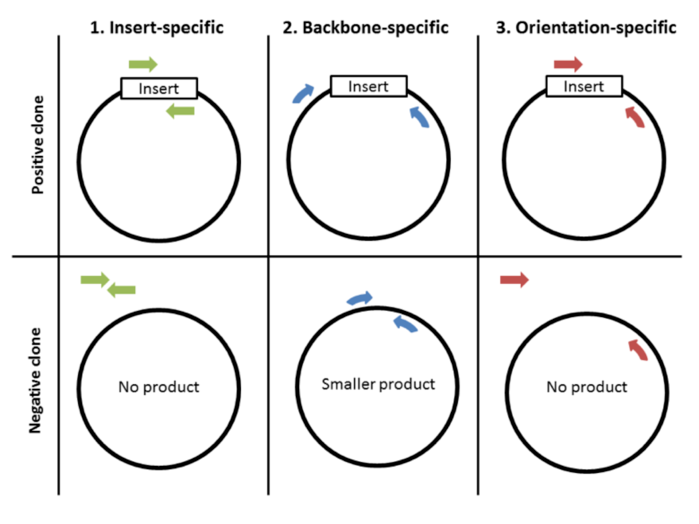
菌落 PCR 的第一步也是最重要的一步是设计引物。引物设计有 3 种策略:1) 插入特异引物,2) 骨架特异引物,和 3) 方向特异引物。
-
插入特异性引物: 插入特异性引物旨在与插入特异性序列退火。这是一种“是或否”的测试,阳性克隆扩增产物,阴性克隆导致无产物。此外,这种类型的引物只会告诉您是否存在您的特定插入片段,而不会告诉您它的方向是否正确,或者它是否位于您的质粒骨架中。
-
骨架特异性引物: 第二种选择是设计骨架特异性引物。这些引物旨在与插入位点侧翼的位点退火。阳性克隆将产生比没有插入片段的阴性克隆更大的产物。这种类型的引物对可以告诉您插入片段的大小是否正确以及它是否在您的骨架内。这种类型的引物对也非常适合筛选具有相同骨架但包含不同插入片段的克隆。当您设计引物在克隆位点外退火时,插入的序列是什么并不重要,允许您使用相同的引物对来筛选是否存在许多不同的插入。缺点:这种类型的引物不提供有关插入物方向的信息。
-
方向特异性引物: 如果您需要有关插入方向的信息,那么您可以考虑设计方向特异性引物。钝端克隆是您可能想知道插入物方向的一个例子。这种类型的引物对的一个成员与插入片段侧翼的序列退火,一个引物与插入片段退火。创建这种类型的引物对的一种简单方法是混合匹配插入特异性和骨架特异性引物。
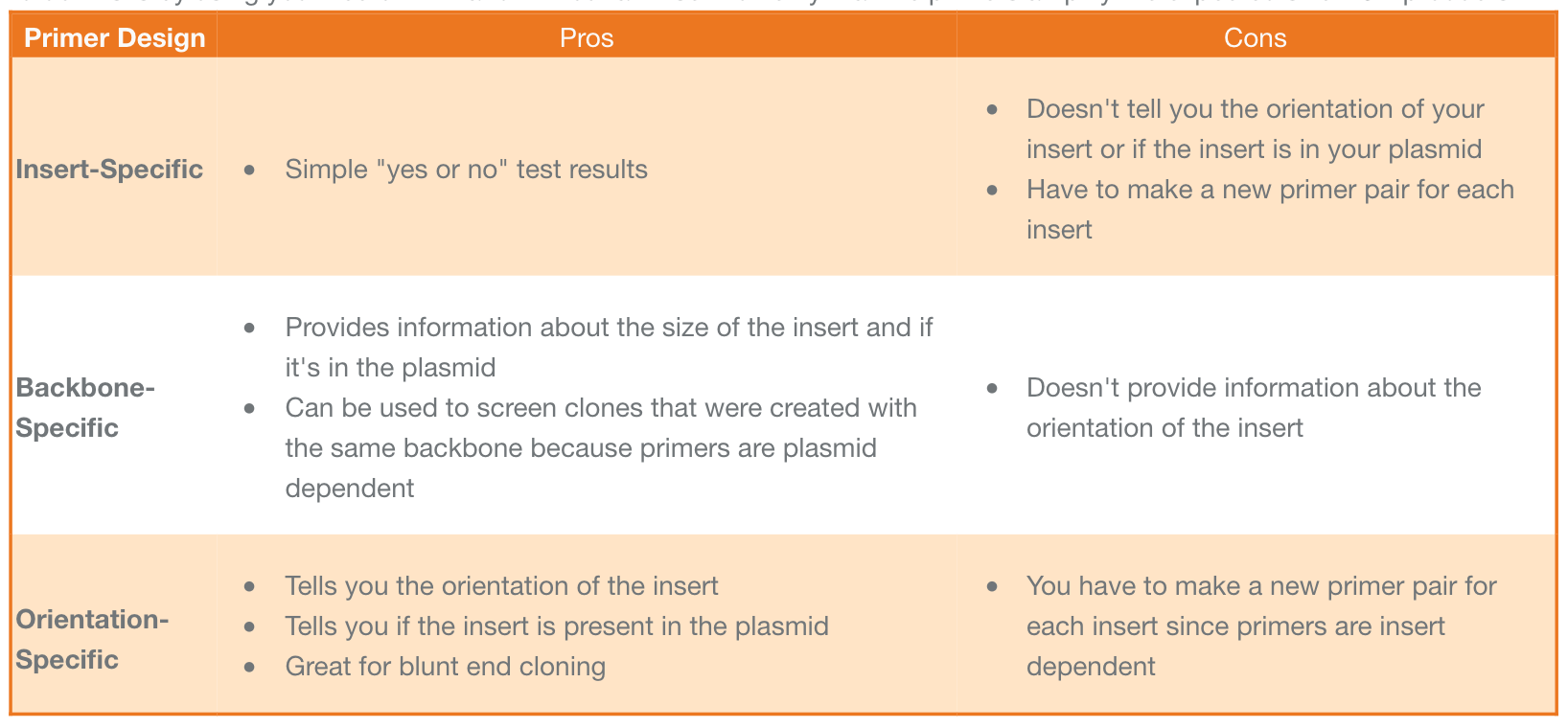
每种方法都有其优点和缺点,下表总结了这些优点和缺点。您使用的引物类型取决于您的偏好。无论哪种方式,请确保在使用菌落 PCR 引物筛选菌落之前对其进行测试。最好的方法是使用带有或不带有插入片段的载体来验证引物扩增预期大小的 PCR 产物。
PCR设置 PCR set-up
设置菌落PCR 反应与准备标准 PCR 反应几乎相同:组合模板、引物、聚合酶和 dNTP,然后使用标准 PCR 热循环程序进行孵育。一个关键的区别是质粒 DNA 必须从细菌中释放出来才能作为 PCR 模板。下面重点介绍了处理这个问题和其他一些菌落 PCR 技巧。
-
准备模板:用无菌扁平牙签或移液器吸头挑出一个菌落,并在少量无菌水中旋转。总共选择 3-10 个菌落进行测试,具体取决于您的无连接控制板上的背景菌落数量。背景越多,您需要筛选的菌落就越多。
-
保存克隆以供以后培养:此时,您需要保留克隆以备后用。有几种方法可以做到这一点。如果您打算在同一天完成您的菌落 PCR 分析,您可以保存剩余的细菌-水悬浮液并使用它们开始您的阳性克隆的培养。如果您想长期保存您的克隆,只需在LB 平板上划线即可。您可以使用此板开始液体培养。最后,您可以使用您挑选的克隆开始小型过夜液体培养,并且只对阳性克隆进行微量制备。无论您选择哪种方法,请务必使用合适的抗生素进行选择。
-
裂解细菌并建立 PCR 反应:剩余的细菌-水悬浮液将作为 PCR 反应的模板。您只需在使用前短暂煮沸样品或直接将少量样品添加到 PCR 反应中,即可裂解细菌以释放质粒 DNA。细菌将在 PCR 反应的初始加热步骤中裂解。标准的 Taq 聚合酶就足够了。
-
控制: 控制可以成就或破坏实验。菌落 PCR 的最佳对照与用于验证菌落 PCR 引物是否首先起作用的对照相同:有或没有插入物的骨架载体。这些对照是您在凝胶上运行 PCR 产物以确定菌落是否包含插入片段时可以使用的快速参考。它们还可用作 PCR 反应的对照。运行无模板对照 PCR 反应来检测污染也是一个好主意。
分析凝胶上的 PCR 产物大小
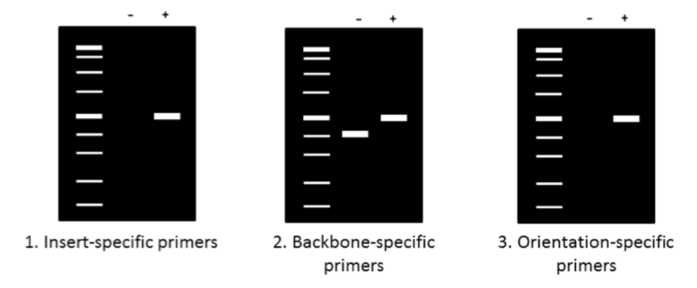
现在您的 PCR 已完成,是时候在琼脂糖凝胶上运行产品以确定它们的大小了。确保使用合适的分子量标准作为参考,并在将样品移液到凝胶上之前向样品中添加含有甘油的加载染料。上图总结了先前描述的三种引物的一般预期结果。使用插入特异性引物 (1) 时,阳性克隆 (+) 会产生条带,而阴性克隆 (-) 则不会。与阴性克隆相比,主干特异性引物 (2) 为阳性克隆 (+) 提供了更大的产物。最后,方向特异性引物 (3) 给出与插入片段特异性引物相同的带 (+) 或不带 (-) 结果,但还会告诉您插入片段是否具有正确的方向性。
使用 Sanger 测序验证插入序列
确定几个阳性克隆后,最后一步是对这些克隆进行小量制备,并将质粒提交给 Sanger 测序。测序可让您确认插入片段的序列、插入片段的方向以及质粒和插入片段 DNA 之间的连接序列。菌落 PCR 将大大减少您需要发送进行测序的克隆数量,但不会告诉您您的产品是否有任何突变。
有许多不同的克隆策略,但无论您最喜欢哪一种,菌落 PCR 都是您分子生物学工具包中的有用工具。下次筛选阳性克隆时可以考虑尝试一下!
替补席上的提示和技巧 Tips and tricks from the bench
-
不要选择太大的colony。过多的细菌会抑制您的 PCR 反应或导致非特异性产物出现在您的凝胶上。
-
谨防误报(Beware of false positives.)。仅仅因为您获得了预期大小的 PCR 产物并不意味着您的插入片段中没有突变。在继续您的实验之前,请确保提交多个阳性克隆进行测序以验证插入序列。
-
较短的扩增子往往更好。较短的扩增子可以缩短 PCR 程序,并且更有可能在含有细菌碎片的 PCR 反应中起作用。
-
使用阳性对照。一个好的阳性对照是用相同骨架质粒转化的细菌。如果此对照不能扩增产物,那么您就知道 PCR 设置和/或引物设计可能有问题。
-
使用阴性对照菌株。良好的阴性对照菌株是您用于克隆的相同细菌菌株的未转化培养物。这种类型的控制对于插入特定的引物尤其重要。如果您的阴性对照扩增了预期大小的产物,您就知道您的细菌基因组已经包含您的目标序列。
参考资料
