【1.6.2.6】白细胞介素Interleukin(IL6)
白介素6(IL-6)作为一种标志物在临床中得到了广泛的应用,特别是在新型冠状病毒诊疗期间的优异表现一鸣惊人。那么白介素6到底是一种什么物质?有什么作用呢?且听小编细细道来。

一、白介素6是什么?
白细胞介素6,简称IL-6,是一种属于白细胞介素的细胞因子。它是由纤维母细胞、单核/巨噬细胞、T淋巴细胞、B淋巴细胞、上皮细胞、角质细胞、以及多种瘤细胞所产生。
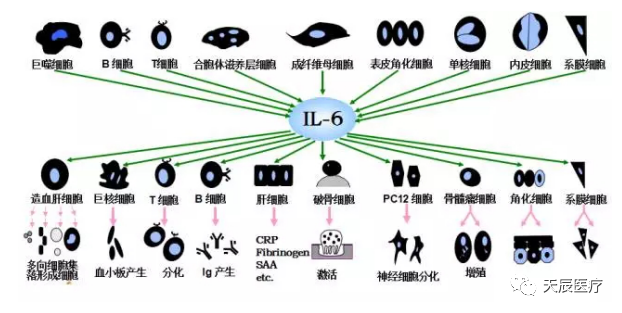
白介素6能够刺激参与免疫反应的细胞增殖、分化并提高其功能,与IL-1一起可协同促进T细胞增殖,对IL-3的多向祖细胞刺激作用有协同效果,还可促使B细胞的分化,并参与炎症反应和发热反应。IL-6是细胞因子网络中的重要成员,在急性炎症反应中处于中心地位,IL-6产生后诱导产生PCT和CRP生成。
二、白介素6具有什么功能?
IL-6在人体代谢、自身免疫、细胞分化、疾病治疗等方面都有重要作用。IL-6信号传导通路中的不同分子更是作为多种疾病治疗的靶点,被用来开发抗体药物。接下来我们就对IL6这一“天生强大”的明星分子有何“过人之处”。
白介素IL-6属于多效细胞因子,仅仅是“昵称”就有一大堆:B细胞分化因子、干扰素β2、肝细胞刺激因子、细胞毒性T细胞分化因子和B细胞刺激因子-2。
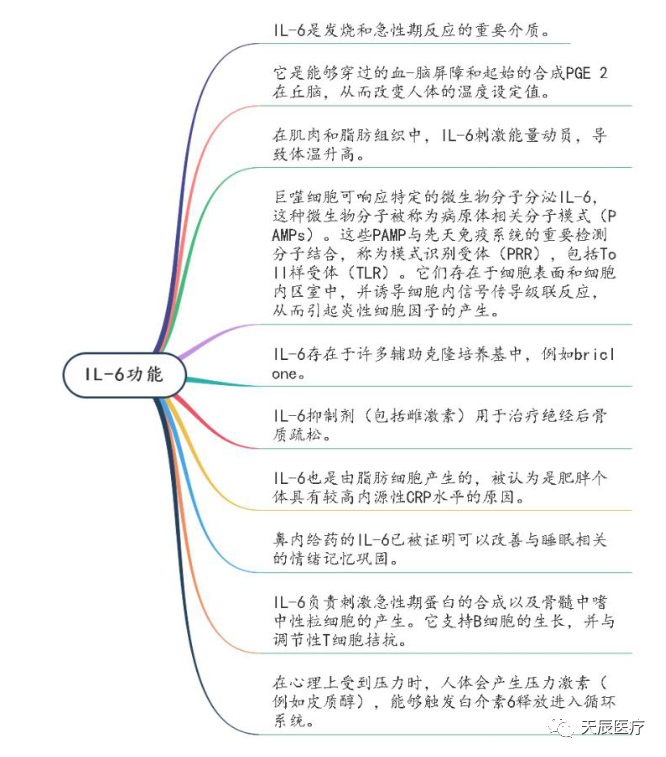
IL-6在功能方面更是强大,能够促进T细胞群体扩增和活化以及B细胞分化,调节急性期反应,可以影响血管疾病、脂质代谢、胰岛素抵抗、线粒体活动、神经内分泌系统和神经心理行为的激素样属性。此外,IL-6促进破骨细胞和血管生成的分化、角化细胞和肾小球膜细胞的增殖、以及骨髓瘤和浆细胞瘤细胞的生长。IL-6还可以控制各种稳态功能,包括葡萄糖代谢、下丘脑-垂体-肾上腺(HPA)轴,影响心情、疲劳、抑郁、以及造血。
IL-6的“天生强大”还体现在来源上:它几乎可以由所有的基质细胞和免疫系统细胞产生。
IL-6在人体代谢、自身免疫、细胞分化、疾病治疗等方面都有重要作用。IL-6信号传导通路中的不同分子更是作为多种疾病治疗的靶点,被用来开发抗体药物。接下来我们就对IL6这一“天生强大”的明星分子有何“过人之处”。
白介素IL-6属于多效细胞因子,仅仅是“昵称”就有一大堆:B细胞分化因子、干扰素β2、肝细胞刺激因子、细胞毒性T细胞分化因子和B细胞刺激因子-2。
IL-6在功能方面更是强大,能够促进T细胞群体扩增和活化以及B细胞分化,调节急性期反应,可以影响血管疾病、脂质代谢、胰岛素抵抗、线粒体活动、神经内分泌系统和神经心理行为的激素样属性。此外,IL-6促进破骨细胞和血管生成的分化、角化细胞和肾小球膜细胞的增殖、以及骨髓瘤和浆细胞瘤细胞的生长。IL-6还可以控制各种稳态功能,包括葡萄糖代谢、下丘脑-垂体-肾上腺(HPA)轴,影响心情、疲劳、抑郁、以及造血。
IL-6的“天生强大”还体现在来源上:它几乎可以由所有的基质细胞和免疫系统细胞产生。
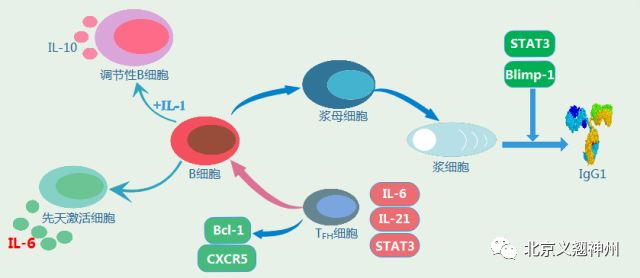
IL-6在多种癌细胞中过量表达。IL-6和STAT3信号传导不仅对于肝脏中的癌症发展是重要的,而且在其它组织如肺、乳腺、肠上皮和造血室中也是必需的。癌细胞更广泛依赖IL-6信号传导——癌细胞中的IL-6信号传导能够促进肿瘤生长、进展以及复发的危险。
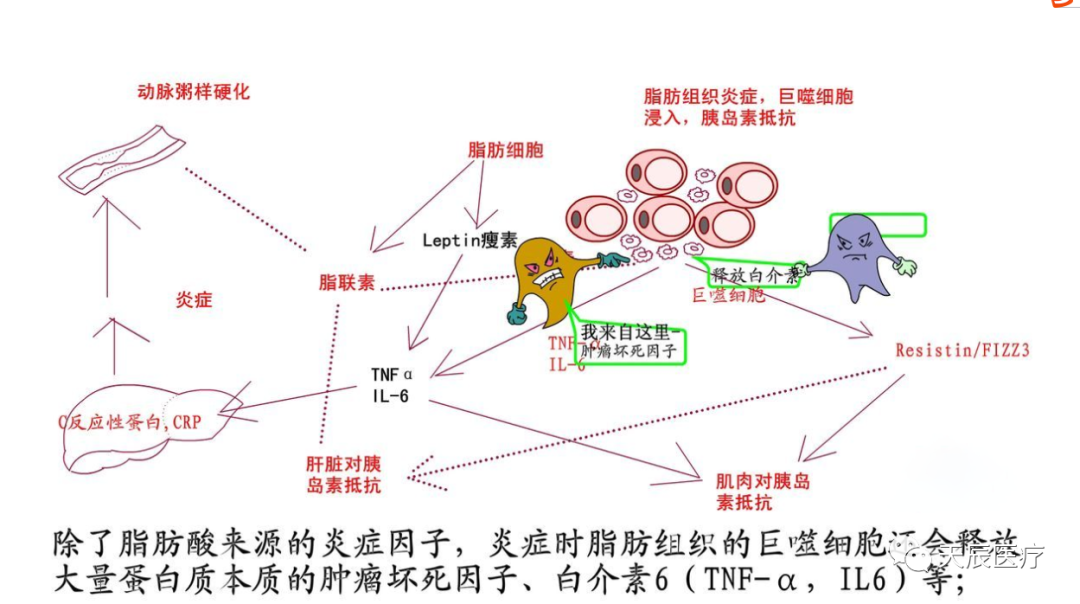
此外白介素IL-6是肥胖和糖尿病研究中最突出的炎症细胞因子之一。IL-6通常用作肥胖相关的的标志物,其血清浓度与脂肪量增加呈正相关。
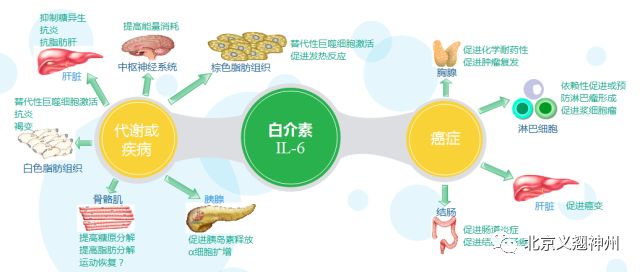
三、白介素6在疾病中有什么作用?
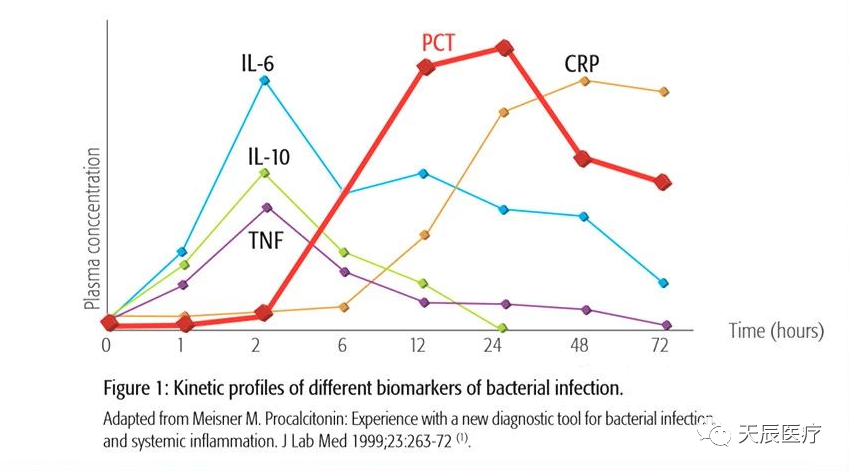
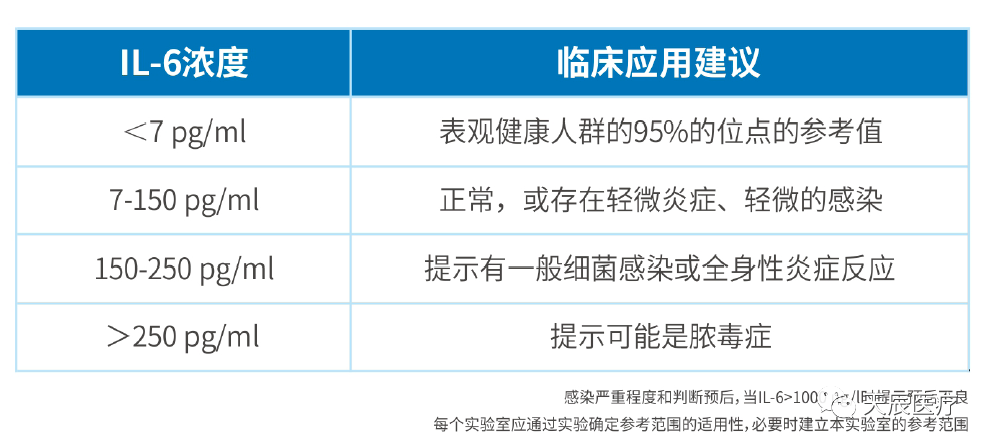
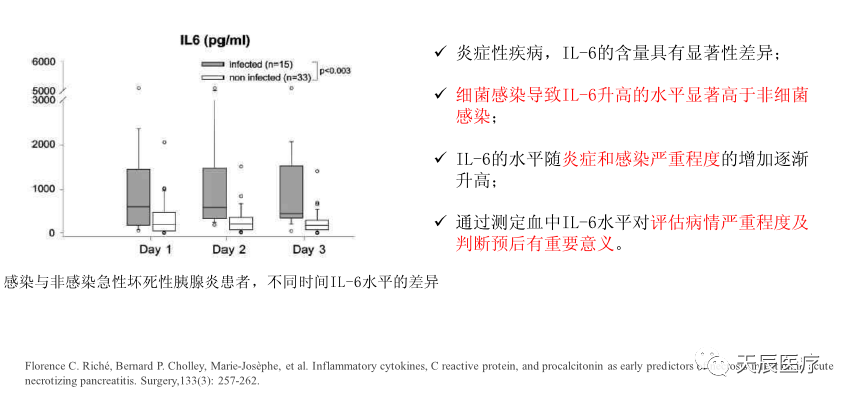
目前临床应用和研究最广泛的感染标志物是降钙素原(PCT)、C反应蛋白(CRP)。而白介素6(IL-6)在自身的多种临床用途中,其作为感染标志物的意义正在逐渐为业内所研究、重视并越来越多地应用于临床。
3.1 白介素6与炎症及感染性疾病的诊断
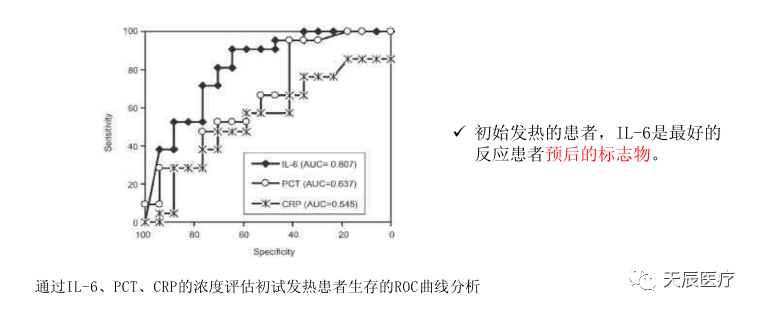
3.2 白介素6是引发新冠肺炎患者炎症风暴中的两个关键炎症因子之一。
白细胞介素6(IL-6):诱发炎症风暴的重要通路
新冠肺炎疫情爆发后,通过安徽省、中国科大的应急项目支持,中国科大生命科学与医学部魏海明教授的团队第一时间就将实验室前移到附一院感染病院区,与中国科大附一院副院长、呼吸内科主任医师徐晓玲教授的团队开展联合攻关。
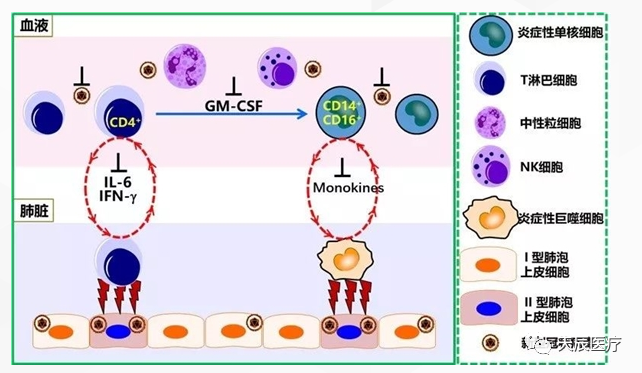
研究团队对33例新冠肺炎病人血液30项免疫学指标的全面分析,发现了新型冠状病毒感染致重症肺炎炎症风暴的关键机制:新型冠状病毒感染后,迅速激活病原性T细胞,产生粒细胞-巨噬细胞集落刺激因子GM-CSF和白介素6等因子。
GM-CSF会进一步激活CD14+CD16+炎症性单核细胞,产生更大量的白介素6和其他炎症因子,从而形成炎症风暴,导致严重肺部和其他器官的免疫损伤。
因此,白介素6和GM-CSF是引发新冠肺炎患者炎症风暴中的两个关键炎症因子。
在国家卫生与健康委员会办公厅和国家中医药管理局办公室2月14日联合发布的“关于印发新型冠状病毒肺炎重型、危重型病例诊疗方案(试行第二版)的通知”中,已经明确将白介素6进行性上升作为病情恶化的临床预警指标。
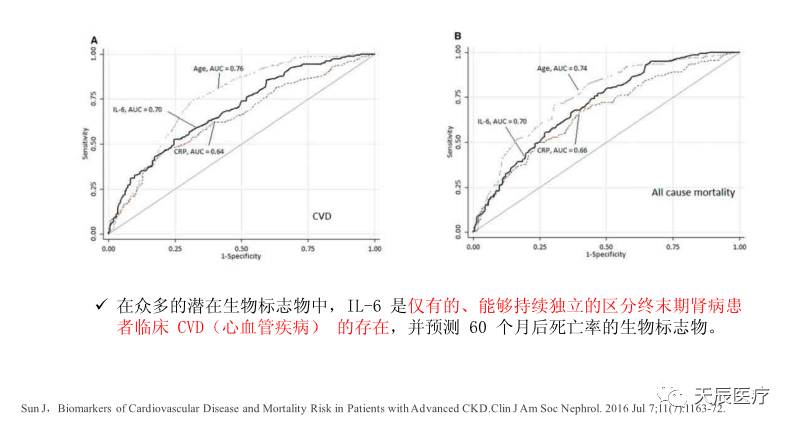
3.3 白介素6与心血管疾病
四、IL6 信号传导方式
IL-6信号传导主要有3种通路,即经典信号传导、反式信号传导和反式呈递。
在经典信号传导通路中,IL-6与其受体IL-6R结合,形成复合物,再与膜蛋白gp130结合,启动细胞内的信号传导。IL-6R仅在少数细胞表达,如肝细胞、一些白细胞和上皮细胞,但gp130几乎可以在所有细胞上表达。研究发现表达gp130但不表达IL-6R的细胞不能结合IL-6引起信号反应。
在反式信号传导通路中,IL-6R以可溶形式(sIL-6R)存在。sIL-6R与IL-6结合的亲和力与IL-6R相似,其结合复合物与gp130结合,进而启动细胞内的信号传导。这一信号通路主要针对由于不表达IL-6R而不能响应IL-6信号,但可以被sIL-6R-IL-6的复合物刺激,从而引起细胞信号传导。
反式呈递信号通路是近期研究发现的,主要发生在提供IL-6信号的树突细胞和接受IL-6的T细胞的抗原特异性相互作用。IL-6与树突细胞内的IL-6R结合后,被运输到质膜,识别T细胞并响应gp130,使T细胞中的STAT3磷酸化,启动信号传导过程。
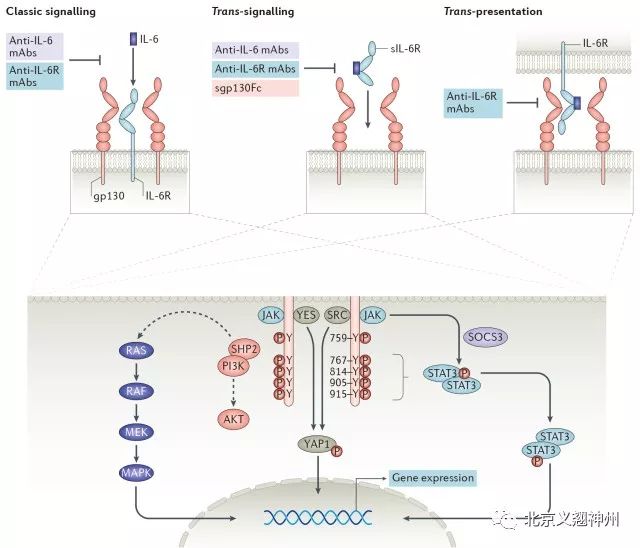
图三. IL6 三种信号传导方式
IL-6在细胞内的信号传导主要通过JAK1发生。以上三种不同的信号通路模式都会通过gp130的同二聚化而会聚于质膜,激活细胞内的RAS-MAPK-PI3K信号通路以及STAT1和STAT3的磷酸化和活化。一旦磷酸化,STAT3形成同二聚体并在细胞核中充当转录因子。Tyr-759充当衔接分子SHP2(也称为PTPN11)的停靠位点,其对于启动PI3K-AKT和MAPK信号传导途径是重要的。Tyr-759也是细胞因子信号传导3(SOCS3)的负反馈蛋白抑制因子的停靠位点,其导致信号传导的抑制。SRC激酶家族成员YES和SRC使YAP1磷酸化,YAP1因此易位至细胞核,在那里与转录因子相互作用以控制与细胞生长和增殖相关基因的转录。
针对IL-6信号通路,研究开发了一系列靶向IL-6信号步骤的抑制剂,抑制IL-6、IL-6R、gp130、STAT3等。
五、IL6蛋白结构
通过对IL-6蛋白结构的研究,发现IL-6阻断位点有三个。
IL-6R可以在IL-6结合位点被抗体靶向,也可以让抗体结合IL-6-sIL-6R复合物,来阻断IL-6反式信号传导。在细胞内,JAKs可以被不同选择性的小分子激酶抑制剂阻断,STAT3也可被CpG-STAT3诱饵或CpG靶向。这些抑制剂有些已经用于临床治疗,还有一些在科研实验阶段。

IL-6已经被确认为许多疾病的驱动信号。许多疾病的动物模型也揭示了IL-6在疾病发展中的病理作用,并且通过基因敲除或施用抗IL-6或抗IL-6R抗体的IL-6阻断可以抑制预防性或治疗性疾病发展。例如,IL-6阻断策略明显地限制了IL-6转基因小鼠类风湿性关节炎、系统性红斑狼疮、硬皮病、C肽诱导的肌炎等疾病。
目前对于IL-6及其相关分子抗体的研究应用,已经扩展到多种类别的疾病,如器官特异性自身免疫性疾病,包括克罗恩病、复发性多软骨炎、获得性血友病A、自身免疫性溶血性贫血,以及慢性炎性疾病如成人发病Still氏病、淀粉样蛋白A淀粉样变性、风湿性多肌痛、缓解血清阴性对称滑膜炎与斑点水肿、贝切特氏病、葡萄膜炎、移植物抗宿主病和肿瘤坏死因子受体相关的周期性综合征。这些新型生物制剂通过抑制IL-6与跨膜和可溶性IL-6R结合来阻断IL-6介导经典和反式信号传导途径。
六、细胞因子风暴
说到IL-6,就不得不说一下细胞因子风暴。研究发现细胞因子风暴已经成为影响细胞免疫治疗效果的重要因素,尤其在Car-T治疗中。
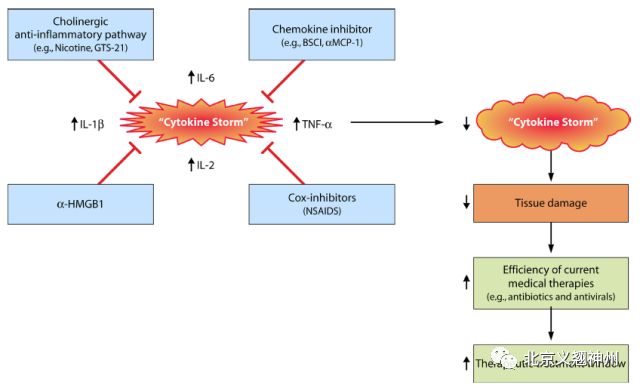
图五. 细胞因子风暴
IL-6可以作为细胞因子风暴中疾病严重程度和预后指标的生物标志物,其表达优于TNF-α和IL-1。通过触发反式信号传导途径,高浓度的IL-6可以诱导血栓形成、血管渗漏和心肌功能障碍相关的各种病理功能,导致组织缺氧、低血压、多器官功能障碍和弥散性血管内凝血。单独给药tocilizumab(一种IL-6抑制剂),可以快速的改善细胞因子释放综合征,对血清中细胞因子如IL-6、IFN-γ、IL-8、IL-10和MCP-1的表达水平产生影响。
IL-6作为一种多生理功能的关键细胞因子,调节免疫细胞增殖和分化。IL-6信号传导的失调与炎症、淋巴增殖性疾病等有关。目前,针对IL-6、IL-6R及相关激酶(JAK)等抑制剂抗体药物已经用于临床,但是哪种阻断方式更有效,副作用更小,怎样维持IL-6的稳态功能,避免因IL-6缺乏导致对病毒、寄生虫和细菌感染的先天和适应性免疫受损,尚需要进一步的研究。
参考资料
