【1.2.2】免疫效应分子--补体系统
19 世纪末,Bordet 发现并证实在人和动物新鲜血清中存在一种 不耐热的成分,可辅助和补充特异性抗体介导的溶解细菌,称为补体 (complement,C)。现已知补体是存在于新鲜血液中的一组不耐热的成 分,由 30 多种蛋白组成,故称为补体系统(complement system)。补 体成分广泛存在于血清、组织液和细胞表面。通常体内大多数补体组 分以无活性形式存在,只有当病原体或抗原-抗体复合物与其相遇、使 之活化后才能发挥溶解细胞、介导炎症反应、调理吞噬、调节免疫应 答和清除免疫复合物等生物学作用。补体系统是一个具有精密调控机 制的蛋白质反应系统。补体系统不仅是机体固有免疫系统的重要组成 部分,在特异性免疫应答过程中也发挥重要作用。补体过度活化、补 体组分缺陷和功能障碍与多种疾病的发生发展密切相关。
一、补体系统的组成和命名
1.1 补体系统的组成
根据补体系统各成分的功能不同,可将其分为补体固有成分、补 体调节蛋白和补体受体三类。 1.补体固有成分 是指存在于血浆和体液中、构成补体基本组 成的蛋白质,包括:1参与经典途径的 C1(C1q、C1r、C1s)、C4 和 C2; 2参与凝集素途径的甘露聚糖结合凝集素(MBL)、纤维胶原素(FCN) 和 MBL 相关的丝氨酸蛋白酶(MASP);3参与旁路途径的 D 因子、 B 因子和备解素(properdin,P 因子)等;4参与三条激活途径共同成分 C3、C5、C6、C7、C8 和 C9。
2.补体调节蛋白 是指存在于血浆中和细胞膜表面,通过调节 补体激活途径中关键酶而控制补体活化强度和范围的一类蛋白质分 子,包括血浆中的 Cl 抑制物、I 因子、H 因子、S 蛋白、C4 结合蛋 白、过敏毒素灭活因子等可溶性调节蛋白和细胞膜表面的膜辅助蛋白 (MCP)、衰变加速因子(DAF)、同源限制因子等膜结合蛋白。
3.补体受体(complementreceptor,CR) 存在于不同细胞膜表 面,能与补体活性片段结合,介导多种蛋白生物学效应的分子,主要 包括 CR1、CR2、CR3、CR4、CR5、C3aR、C4aR、C5aR、C1qR 及 H 因子受体(HR)等。
1.2 补体系统的命名
1968 年,世界卫生组织(WHO)对补体进行了统一命名。补体 以 C 表示。将参与经典激活途径和终末途径的补体成分,按其发现的 先后顺序以 C1~C9 命名,其中 C1 又由三个亚单位组成,分别命名 C1q、C1r 和 Cls;旁路途径的特有成分以英文大写字母表示,如 B 因 子、D 因子、P 因子等;少数以参与补体激活成分的名称命名,如纤 维胶原素(FCN)、甘露聚糖结合凝集素(MBL)和 MBL 相关丝氨酸 蛋白酶(MASP);补体调节蛋白多以其功能命名,如 Cl 抑制物、C4 结合蛋白、衰变加速因子(DAF)和补体受体等。补体活化后产生的 裂解片段,以该补体组分符号后加小写英文字母表示,如 C3 裂解产 物为 C3a 和 C3b;具有酶活性的成分或复合物在其上方画一横线表 示,如 $C\overline{1}$、$C\overline{4b2a}$。灭活的补体片段在其符号前加英文字母 i 表示,如 iC3b。
二、补体系统的理化性质
体内多种组织细胞如由肝细胞、单核/巨噬细胞、角质细胞、造血 细胞、内皮细胞以及肠粘膜上皮细胞等均能合成补体分子,其中肝细 胞和巨噬细胞是产生补体的主要细胞。补体成分均为糖蛋白,大多是 β球蛋白,少数为α或γ球蛋白。补体性质不稳定,56°C温浴30分钟即 被灭活;在室温下也会很快失活;在0~10°C条件下,补体活性只能 保持3~4天,故补体应保存在-20°C以下或冷冻干燥保存。此外,紫外 线照射、机械震荡、强酸强碱或乙醇等也可使补体破坏。
血清中补体含量相对稳定,约占血清球蛋白总量的10%,其中C3 含量最高(0.5~1.3mg/ml),D因子含量最低(0.001~0.002mg/ml)。C1q 分子量最大(410kD)、D因子分子量最小(25kD)。血浆补体成分 约90%由肝脏合成,炎症组织中补体成分约90%是从血液中扩散而来 的。多种促炎细胞因子可刺激补体基因转录和蛋白质合成。感染、组 织损伤急性期及炎症状态下,补体产生增多,血浆补体水平升高。
三、补体的激活途径
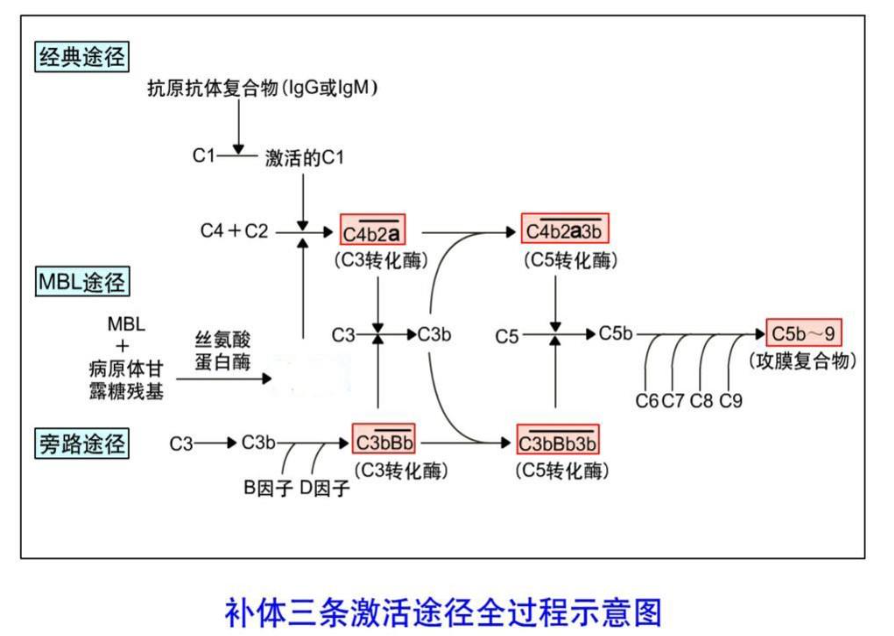
补体系统各成分通常以非活性状态存在,只有在某些激活物刺激 作用下,补体固有成分按一定顺序,以级联酶促反应方式依次活化, 形成 C3/C5 转化酶和攻膜复合物(membrane attack complex,MAC) 产生一系列生物学效应的过程。补体系统可通过三条途径激活,即从 C1 活化启动的经典激活途径(classical pathway),又称传统途径;从 甘露聚糖结合凝集素(MBL)活化启动的 MBL 激活途径(mannan - binding lectin pathway);从 C3 自发水解或活化启动的旁路激活途径 (alternative pathway),又称替代途径。它们有共同的末端通路。

3.1 经典激活途径
参与经典激活途径的补体成分包括 C1~C9。按其在激活过程中 的作用,分成三个阶段,即识别阶段、活化阶段和膜攻击阶段。
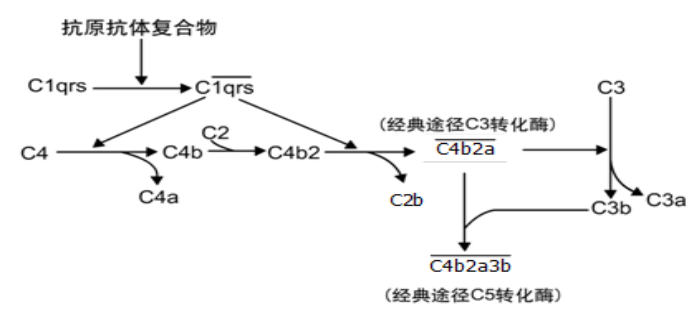
补体激活的经典途径示意图
(一)识别阶段
Cl 识别免疫复合物形成活化的 C1 酯酶阶段。C1 是由一个 Clq 分子与两个 Clr-Cls 分子依赖 Ca2+维系而成的大分子复合物,Clq 分 子有 6 个相同的球形结构,此结构能识别抗体(IgG、IgM)分子上的 补体结合点。当抗体(IgG、IgM)与抗原结合后,抗体发生变构,暴 露出 Fc 段上的补体结合点,C1q 的球形结构与之结合(桥联),导致 C1q 构象改变,进而使 C1r 和 C1s 的相继活化。C1q 分子中 2 个以上 的球形结构与抗体分子的 Fc 段结合才能使 C1q 构形发生改变,从而 导致与之相连的 C1r 和 C1s 相继活化。活化的 Cls 具有丝氨酸蛋白酶 活性(用 C1s 表示),它可依次裂解 C4 和 C2。一个 IgM 分子与抗原 结合后即能激活 C1,而 IgG 分子则至少需要两个紧密相邻的抗体分 子与抗原结合后方可激活 C1。
(二)活化阶段
活化阶段是形成 C3 转化酶( $C \overline{4b2a} $ )和 C5 转化酶( $C \overline{4b2a3b} $ ) 的阶段。C4 和 C2 都是 C1s 的天然底物。C1s 使 C4 裂解成 C4a 和
C4b 两个片段,C4b 与抗原抗体复合物所在的靶细胞膜结合。在 Mg2+存在时,C2 可与 C4b 结合,被 C1s 裂解为 C2a 和 C2b。C2a 与 C4b 结合形成 $C \overline{4b2a} $ 复合物,即 C3 转化酶。C3 被 C3 转化酶(C
$C \overline{4b2a} $ )裂解成 C3a 和 C3b 两个片段,C3b 与细胞膜上 $C \overline{4b2a} $ 形成$C \overline{4b2a3b} $ 复合物,即 C5 转化酶,进入共同的末端通路。
补体裂解过程中生成的小分子 C4a、C2b、C3a 释放到液相中, 发挥各自的生物学活性。
3.2 MBL 激活途径
MBL 激活途径又称凝集素途径,是指血浆中 MBL 与直接识别多
种病原微生物表面的糖结构(如甘露糖、岩藻糖残基或 N-乙酰葡糖 胺、N-乙酰半乳糖胺等)结合后,依次活化 MBL 相关丝氨酸蛋白酶 (MBL-associated serine protease,MASP)、C4、C2、C3,形成 C3 转 化酶和 C5 转化酶的级联酶促反应过程。MBL 的分子结构与 C1q 分 子相似,与两分子 MASP1-MASP2 结合成 MBL-MASP1/2 复合体。 MBL 与病原体表面的糖类结构结合后,可因 MBL 的构象改变而使与 之相连的 MASP1 和 MASP2 相继活化,活化的 MASP2 具有丝氨酸 蛋白酶活性,能以与活化的 C1($C \overline{1s} $ )相同的方式依次裂解 C4 和 C2, 形成 C3 转化酶,进而激活后续补体成分。
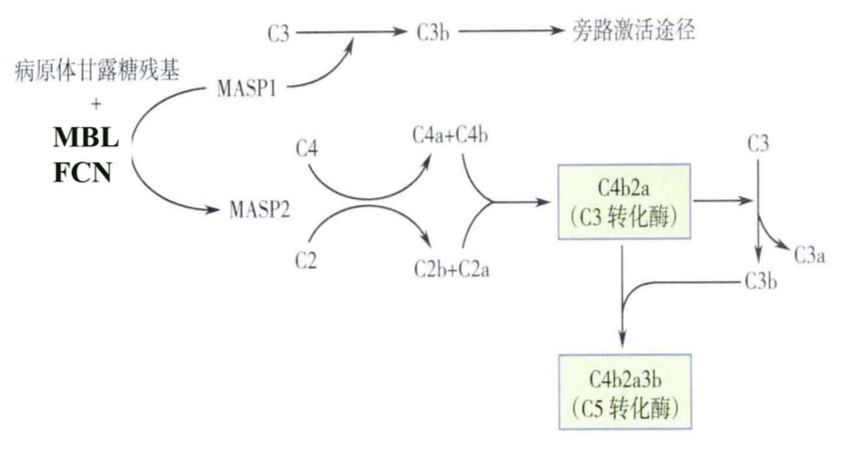
补体激活的 MBL 途径示意图
3.3. 旁路途径
旁路激活途径又称替代途径,是以某些细菌、真菌或细菌脂多糖 (内毒素)、酵母多糖、葡聚糖、凝聚的 IgA 和 IgG4 等为激活物, 直接与 C3b 结合后,在 B 因子、D 因子和 P 因子参与下形成 C3 转 化酶,继而引发级联酶促反应的补体活化途径。旁路途径不需要抗 体参与,可由微生物或外源异物直接激活。该途径是最早出现的补 体活化途径,是抵抗病原体感染的第一道防线。
旁路途径从 C3b 开始。经典途径中产生或在生理条件下自发产 生的 C3b,如果沉积于正常宿主细胞表面,可被补体调节蛋白降解 而灭活,中止反应。如果沉积在缺乏补体调节蛋白的物质表面,如 微生物(细菌脂多糖)颗粒表面,可与 B 因子结合形成 C3bB。血 清中的 D 因子可将结合状态的 B 因子裂解成 Ba 和 Bb。Ba 进入液 相, Bb仍附着C3b上形成 $C \overline{3bBb} $复合物,该复合物即是旁路途径 的 C3 转化酶。$C \overline{3bBb} $ 复合物不稳定,可迅速被降解。血清中 P 因子与之结合成稳定的 C3 转化酶($C \overline{3bBbP} $),可使更多的 C3 裂解,产 生的 C3b 再沉积于颗粒物质表面,形成更多的 C3 转化酶,可放大 起初的激活作用。C3 被裂解后产生的 C3b,有些沉积在颗粒表面并 与 $C \overline{3bBb} $结合形成 $C \overline{3bBb3b} $ (或称 $C \overline{3bnBb} $ ),该复合物即旁路激活途 径的 C5 转化酶,其功能与经典途径的 C5 转化酶 $C \overline{4b2a3b} $类似,可 使 C5 裂解成 C5a 和 C5b。后续的 C6~C9 各成分活化过程与经典激 活途径相同,形成 MAC,导致靶细胞溶解。同时,旁路途径激活所 产生的的 C3b 可再与 B 因子结合,在 D 因子作用下产生更多 C3 转 化酶($C \overline{3bBbP} $),从而形成旁路途径的 C3 正反馈放大环路。
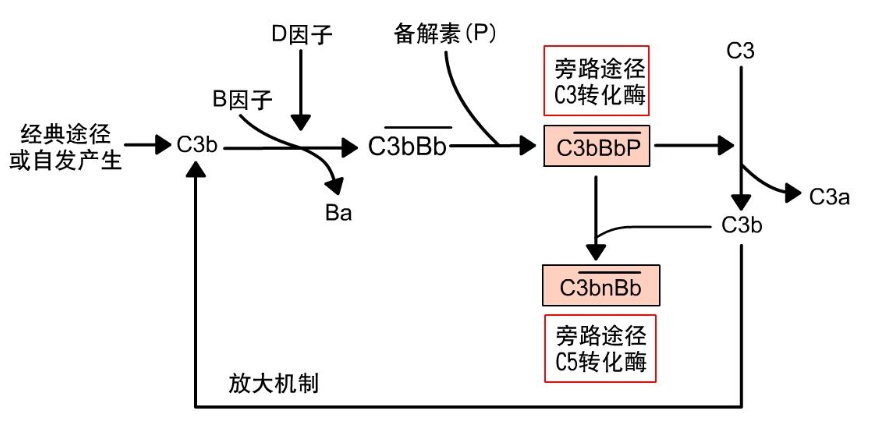
补体激活的旁路途径示意图
3.4 补体活化的共同末端通路
是补体激活过程中的最后一个反应阶段。三条激活途径前端反应 各异,但在此阶段的反应过程完全相同,故称补体激活共同末端通路。 其主要机制是:3 条补体活化途径形成的 C5 转化酶( $C \overline{4b2a3b } $ 或 $C \overline{3bBbP } $)均可将 C5 裂解为 C5a 和 C5b 两个片段:其中 C5a 释放至液 相,为过敏素,也是中性粒细胞的趋化因子;C5b 依次与 C6、C7 结 合形成 C5b67 复合物。继而与 C8 高亲和力结合形成 C5b678 复合物, 深插入细胞膜,使细胞膜出现损伤。在此基础上,C5b678 复合物可 与 12~18 个 C9 分子聚合,形成 C5b6789 复合物,此即攻膜复合物 (membrane attack complex,MAC)。插入细胞膜上的 MAC 形成一个 内径约 11nm 的亲水性穿膜孔道,能使水和电解质通过,而不让蛋白 质类大分子逸出,最终可因胞内渗透压降低、细胞逐步肿胀并最终破 裂。
3.5 补体系统三条激活途径的比较
补体三条激活途径是密切相关的,均以 C3 活化为中心。旁路 途径和 MBL 途径的活化不需抗原抗体复合物参与,故在病原微生 物感染时补体发挥作用顺序依次是旁路途径,MBL 途径,最后是经 典途径。然而当经典途径和 MBL 途径活化时,通过 C3 放大途径也 可活化旁路途径。补体三条激活途径全过程见图,三条激活途径比 较见表。

四、补体激活的调节
补体活化过程受多种调节蛋白的严密控制,以保证补体活化适度 有序;能够做到在不损伤自身组织细胞情况下,协助免疫细胞或其他 免疫分子发挥免疫效应,产生对机体有益的抗感染等免疫保护作用。
4.1 可溶性补体调节蛋白及其作用
1.C1抑制分子(C1 inhibitor,C1INH)
是血浆中一种分子量 为104kd的单链糖蛋白,为丝氨酸蛋白酸抑制剂超家族中的一个成员。 在经典途径激活过程中,他们能被C1s裂解,并与活化C1大分子中的 C1r2-C1s2共价结合形成稳定的复合物,使C1大分子解聚失活,对经典 途径C3转化酶的形成产生抑制作用。它们也能与活化MBL/FCN- MASP1/2复合物中的MASP1/2结合使之失活,对凝集素途径C3转化酶的 形成产生抑制作用。

2.C4结合蛋白(C4-binding protein,C4bp)
- 能与C2或B因子竞争结合C4b或C3b,抑制
$C \overline{4b2a } $或$C \overline{3bBb } $复合物即经典/凝集素或 旁路途径C3转化酶的形成; - 可将C2a从
$C \overline{4b2a } $复合物中置换解离,使经典途径C3转化酶衰变失活; - 作为I因子的辅助因子,与C4b或C3b 结合后可促进I因子对C4b或C3b的裂解作用。
3.H因子(factor H)
- 能与B因子竞争结合C3b,抑制
$C \overline{3bBb } $复合物即旁路途径C3转化酶的形成; - 可将Bb从
$C \overline{3bBb } $复合物中置 换解离,使旁路途径C3转化酶衰变失活; - 作为I因子的辅助因子, 与C3b结合后可促进I因子对C3b的裂解作用。
4.I因子
又称C4b/C3b灭活因子(inactivator);具有丝氨酸 蛋白酶活性,可将与C4bp、H因子或膜表面MCP、CR1结合的液相或膜 结合C4b/C3b裂解灭活,对经典/凝集素或旁路途径C3转化酶(即 $C \overline{4b2a } $或$C \overline{3bBbP } $)的形成产生抑制作用。
- S蛋白(S protein ,SP)
又称攻膜复合物抑制因子;能与 C5b67复合物结合,使其丧失与细胞膜结合的能力,对C5b6789n攻膜 复合物的形成产生抑制作用。
6.过敏毒素灭活剂(anaphylatoxin inactivator,AI)
即血 清羧肽酶N,可去除C3a、C5a羧基末端的精氨酸残基,使之丧失过敏 毒素活性。
4.2 膜结合调节蛋白及其主要作用
膜结合调节蛋白广泛分布于血细胞和其他组织细胞表面,而在病 原体表面缺失;其主要功能是防止机体在抗感染免疫过程中,通过“无 辜旁观”作用方式使宿主自身正常组织细胞发生损伤。“无辜旁观” (innocent bystander)是指补体活化裂解片段C3b/C4b在与病原体等激活物结合时,也能与相邻正常组织细胞结合形成C3转化酶,诱导 产生级联酶促反应使正常组织细胞发生损伤的现象。
1.膜辅助蛋白(membrane cofactor protein, MCP)
广泛分 布于白细胞、上皮细胞、成纤维细胞和其他组织细胞表面;能与结合 在上述自身组织细胞表面的C4b/C3b结合,并协助I因子将其(C4b/C3b) 裂解灭活,对经典/凝集素或旁路途径C3转化酶的形成产生抑制作用, 使自身组织细胞不因补体激活而受到损伤。

MCP/CR1协助I因子裂解灭活C4b/C3b示意图
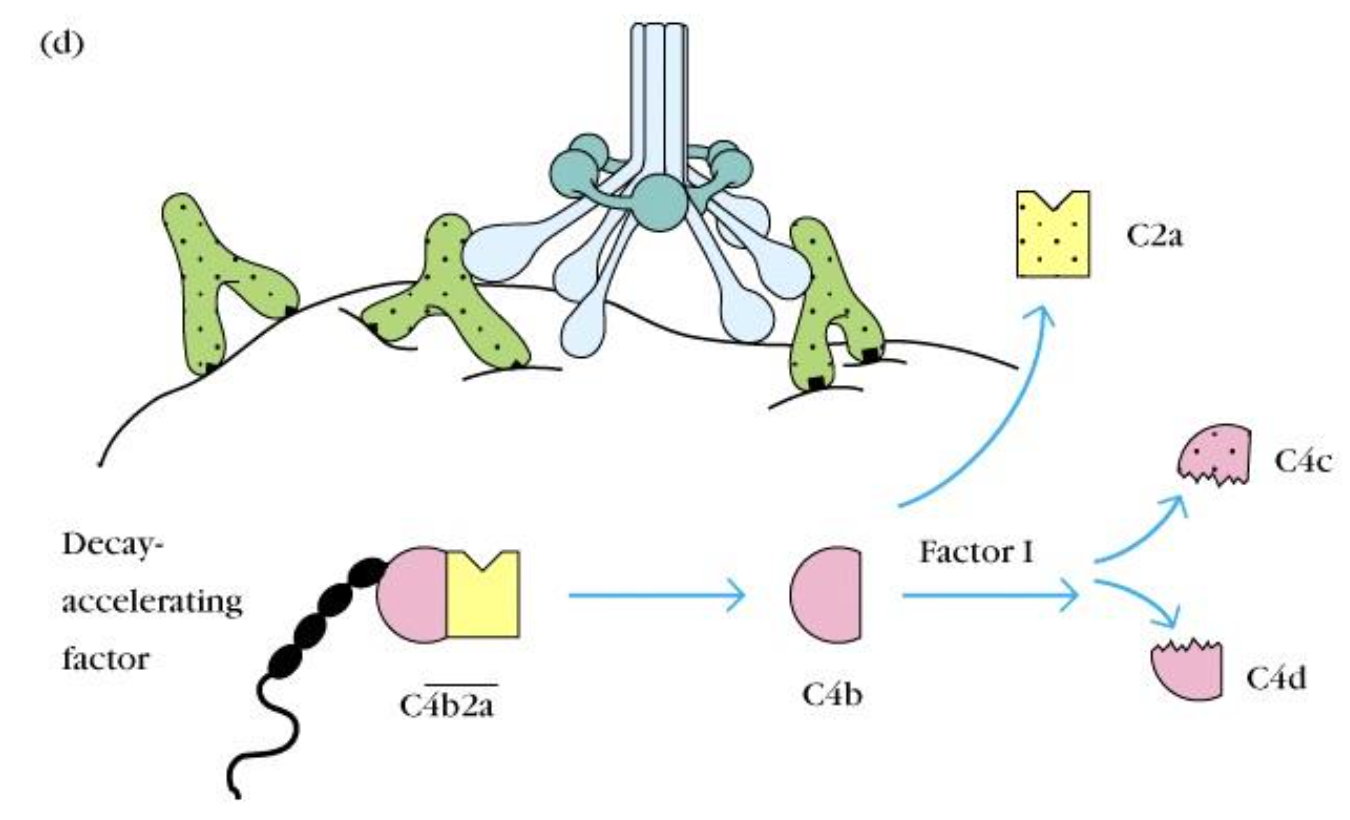
2.衰变加速因子(decay-accelerating factor,DAF)
广泛 分布于血细胞、内皮细胞和黏膜上皮细胞表面;
- 能与上述自身组织 细胞表面结合的C4b/C3b结合,抑制经典/凝集素或旁路途径 C3转化 酶形成(图5-11A);
- 也能将C2a或Bb从细胞膜上瞬间形成的
$C \overline{4b2a } $或$C \overline{3bBb } $复合物中置换解离,导致经典/凝集素或旁路途径C3转化 酶衰变失活,从而保证自身组织细胞不因补体激活而受到损伤。
DAF抑制C3转化酶形成示意图
3.膜反应性溶解抑制物(membrane inhibitor of reactive lysis, MIRL,CD59)
广泛表达于血细胞表面、内皮细胞和上皮细胞表面, 可阻止C9与C5b678复合物结合,抑制攻膜复合物(C5b6789)形成,使 自身组织细胞不被溶解破坏。
4.补体受体1(complement receptor 1, CR1)
广泛表达于红 细胞及有核细胞表面;
- 能与上述自身组织细胞表面结合的C4b/C3b 结合,并协助I因子将C4b/C3b裂解灭活,对抑制经典/凝集素和旁路 途径C3转化酶的形成产生抑制作用(图5-10);
- 也能将C2a或Bb从 细胞膜上瞬间形成的
$C \overline{4b2a } $或$C \overline{3bBb } $复合物中置换解离,导致经 典/凝集素或旁路途径C3转化酶衰变失活。
五、补体的生物学功能
补体是执行非特异免疫作用的效应分子,在适应性免疫应答过程 中也发挥重要作用。补体活化过程中产生的功能性裂解片段和攻膜复 合物可介导产生如下多种生物学作用。
1.溶菌和细胞溶解作用
补体激活产生的攻膜复合物(C5b6789) 在细菌或细胞表面形成穿膜亲水孔道,可使菌细胞、病毒感染或寄生 虫等靶细胞溶解破坏,产生对机体有益的抗感染免疫保护作用;若使 正常组织细胞溶解破坏则可产生对机体有害的病理性免疫损伤。
2.调理作用
补体裂解片段C3b/C4b是一种非特异性调理素 (nonspecific opsonin)。他们通过其断裂端与病原体等颗粒性抗 原结合后,可被具有相应补体受体(C3bR/C4bR)的吞噬细胞识别结 合,从而有效促进吞噬细胞对上述病原体等颗粒性抗原的吞噬杀伤或 清除作用。
3.免疫黏附及其对循环免疫复合物的清除作用
体内循环免疫 复合物(immune complex, IC),即抗原-抗体复合物形成后可激活补 体,并与补体裂解片段C3b共价结合形成抗原-抗体-C3b复合物;红细 胞和血小板表面具有C3b受体(CR1),能与上述免疫复合物中C3b结 合、即通过免疫黏附作用(immune adherence)使循环免疫复合物与 红细胞/血小板结合在一起;进而通过血液循环,由红细胞/血小板将 抗原-抗体-C3b复合物转运到肝脏,被表面具有C3b受体的巨噬细胞识 别结合、有效吞噬清除。上述C3b介导的免疫粘附作用是体内清除循 环免疫复合物的主要途径之一。
4.炎症介质作用
- 补体裂解片段C3a和C5a又称过敏毒素 (anaphylatoxin),他们能与肥大细胞或嗜碱性粒细胞表面相应受 体(C3aR/C5aR)结合,而使上述靶细胞脱颗粒,释放组胺、白三烯 等一系列生物活性介质,引发过敏性炎症反应。
- C5a对中性粒细胞 具有趋化和激活作用:可诱导中性粒细胞表达黏附分子,促进中性 粒细胞与血管内皮细胞粘附,并使之外渗进入感染炎症部位;可激 活中性粒细胞,使其吞噬杀菌能力显著增强。
5.参与适应性免疫应答
补体活化产物可通过以下几种作用方 式参与特异性免疫应答:
- C3b/C4b 介导的调理作用可促进抗原提呈 细胞对抗原的摄取和提呈,有助于适应性免疫应答的启动;
- 抗原- C3d复合物与B细胞表面BCR和BCR辅助受体(CD21/CD19/CD81复合物) 中CD21(C3dR)交联结合,可促进B细胞活化;
- 滤泡树突状细胞可 通过C3bR(CR1)将抗原-抗体-C3b复合物滞留于细胞表面,供抗原特 异性B细胞识别,启动适应性体液免疫应答。
参考资料
- 《医学免疫学》课件 新乡医学院 宋向凤、张国俊、徐春阳、孙爱平、孙书明、赵铁锁等老师
