【1.4.3.2】辅助性T细胞激活B细胞
充当B细胞抗原受体(BCR,B-cell antigen receptor )的表面免疫球蛋白在B细胞活化中具有两个作用。
- 首先,与T细胞上的抗原受体一样,它与抗原结合时会直接将信号传递到细胞内部(请参阅第6-1节)。
- 其次,B细胞抗原受体将抗原以结合MHC II类分子的肽的形式传递到细胞内的位点,在该位点被降解并返回到B细胞表面(参见第5章)。肽:MHC II类复合物可以被抗原特异性的武装(armed)辅助T细胞识别,刺激它们产生蛋白质,进而导致B细胞增殖,其后代分化为分泌抗体的细胞。
在没有T细胞帮助的情况下,某些微生物抗原可以直接激活B细胞。 B细胞直接响应这些抗原的能力提供了对许多重要细菌病原体的快速响应。但是,体细胞超突变和转换为某些免疫球蛋白同种型,取决于抗原刺激的B细胞与辅助T细胞和外周淋巴器官中其他细胞的相互作用。因此,仅由微生物抗原诱导的抗体与由T细胞帮助诱导的抗体相比,变异性较小且功能通用性较低。
9-1 当结合性B细胞通过辅助性T细胞或仅通过某些微生物抗原发出信号时,就会启动体液(humoral)免疫反应
适应性免疫的一般规则是,幼稚的抗原特异性淋巴细胞很难单独通过抗原激活。 幼稚T细胞需要专业抗原呈递细胞的共刺激信号;幼稚的B细胞需要辅助信号,这些信号可以来自武装的辅助性T细胞,或者在某些情况下直接来自微生物成分。
对蛋白质抗原的抗体反应需要抗原特异性T细胞帮助。当与表面免疫球蛋白结合的抗原被内化并作为与MHC II类分子结合的肽,返回到细胞表面时,B细胞可以从武装辅助T细胞获得帮助。识别肽:MHC复合物的武装辅助T细胞随后将激活信号传递至B细胞。因此,与B细胞结合的蛋白质抗原通过交联其抗原受体,既向B细胞提供了特异性信号,又使B细胞吸引了抗原特异性T细胞的帮助。这些抗原无法在缺乏T细胞的动物或人类中诱导抗体反应,因此被称为胸腺依赖性或TD抗原(图9.2,顶部两幅)。
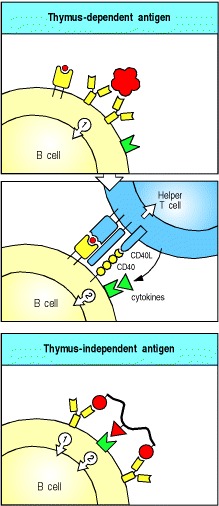
Figure 9.2A second signal is required for B-cell activation by either thymus-dependent or thymus-independent antigens
The first signal required for B-cell activation is delivered through its antigen receptor (top panel). For thymus-dependent antigens, the second signal is delivered by a helper T cell that recognizes degraded fragments of the antigen as peptides bound to MHC class II molecules on the B-cell surface (center panel); the interaction between CD40 ligand (CD40L) on the T cell and CD40 on the B cell contributes an essential part of this second signal. For thymus-independent antigens, the second signal can be delivered by the antigen itself (lower panel), or by non-thymus-derived accessory cells (not shown).
CD19:CD21:CD81的B细胞共受体复合物(参见第6-8节)可以大大增强B细胞对抗原的反应性。 CD21(也称为补体受体2,CR2)是补体片段C3d的受体(请参阅第2-11节)。当用结合了补体片段C3dg的三个连接分子的鸡蛋溶菌酶对小鼠进行免疫时,修饰的溶菌酶诱导的抗体无需添加佐剂,其剂量比未修饰的鸡蛋溶菌酶小多达10,000倍。通过增加B细胞信号传导,通过诱导B细胞上的共刺激分子或通过增加受体介导的抗原摄取,来增强CD21结合来增强B细胞反应性,这一点尚不清楚。正如我们将在本章稍后看到的那样,已经与抗原结合的抗体可以激活补体系统,从而用C3d覆盖抗原并产生更有效的抗原,从而导致更有效的B细胞激活和抗体产生。
尽管B细胞对蛋白质抗原的反应需要武装的肽特异性辅助性T细胞,但是在没有辅助性T细胞的情况下,许多微生物成分(例如细菌多糖)可以诱导抗体的产生。这些微生物抗原被称为胸腺非依赖性或TI抗原,因为它们在没有T淋巴细胞的个体中诱导抗体反应。激活抗体产生TI抗原所需的第二个信号是通过识别常见的微生物成分直接提供的(见图9.2,下图),或者是非胸腺来源的辅助细胞结合B细胞的大量交联而提供的。当B细胞结合细菌细胞上的重复表位时,就会发生这种受体。不依赖胸腺的抗体反应为抵抗细胞外细菌提供了一定的保护,我们稍后会再讨论。
9-2 武装辅助性T细胞激活识别相同抗原的B细胞
T细胞依赖性抗体应答,需要应答相同抗原的辅助T细胞激活B细胞。这称为链接识别(linked recognition)。这意味着在可以诱导B细胞产生针对感染性病原体的抗体之前,必须首先激活对该病原体的肽特异的CD4 T细胞,以产生合适的武装辅助T细胞。据推测,这是通过与抗原呈递树突状细胞相互作用而发生的(请参见第8-1节)。尽管武装辅助T细胞识别的表位因此必须与B细胞识别的表位连接(linked),但两个细胞不必识别相同的表位。确实,我们在第5章中看到T细胞可以识别与B细胞识别的同一蛋白质上的表面表位截然不同的内部肽。对于更复杂的天然抗原,例如病毒,T细胞和B细胞甚至可能无法识别相同的蛋白质。然而,至关重要的是,T细胞识别的肽必须是B细胞识别的抗原的物理部分,这样才能在将与B细胞受体结合的抗原内化后产生合适的肽。
例如,通过识别病毒蛋白外壳上的表位,B细胞可以内化完整的病毒颗粒。 内化后,病毒颗粒被降解,内部病毒蛋白以及外壳蛋白的肽可以通过B细胞表面的II类MHC分子展示出来。 在感染初期,由呈现这些内部肽的巨噬细胞或树突状细胞引发的辅助性T细胞可以激活B细胞,从而产生识别外壳蛋白的抗体(图9.3)。
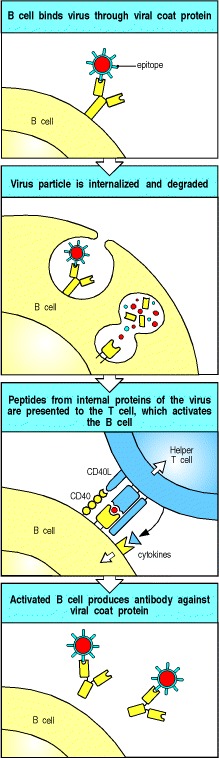
Figure 9.3B cells and helper T cells must recognize epitopes of the same molecular complex in order to interact
An epitope on a viral coat protein is recognized by the surface immunoglobulin on a B cell and the virus is internalized and degraded. Peptides derived from viral proteins, including internal proteins, are returned to the B-cell surface bound to MHC class II molecules (see Chapter 5). Here, these complexes are recognized by helper T cells, which help to activate the B cells to produce antibody against the coat protein.
对相同抗原或病原体敏感的T细胞对B细胞的特异性激活,取决于抗原特异性B细胞在其表面MHC II类分子上浓缩(concentrate)适当肽的能力。与不结合抗原的B细胞相比,结合特定抗原的B细胞在其MHC II类分子上展示该抗原的肽片段的效率高达10,000倍。因此,武装辅助T细胞将仅帮助那些受体结合包含其所识别肽的抗原的B细胞。
连锁识别(linked recognition )的要求对于体液免疫应答的调节和操纵具有重要的意义。一种是连锁识别有助于确保自我宽容,这将在第13章中进行描述。连锁识别的重要应用是疫苗的设计,例如用于免疫婴儿针对B型流感嗜血杆菌的疫苗。这种细菌病原体可以感染脑膜,称为脑膜,会引起脑膜炎,严重时还会造成神经系统损害或死亡。针对这种病原体的保护性免疫是通过针对其荚膜多糖的抗体介导的。尽管成年人对这些多糖抗原做出非常有效的不依赖胸腺的反应,但这种反应在婴儿的未成熟免疫系统中较弱。因此,为了制造一种适用于婴儿的有效疫苗,多糖应与破伤风类毒素化学连接,破伤风类毒素是一种常规且成功地针对婴儿进行免疫接种的外源蛋白质(请参阅第14章)。结合疫苗的多糖成分的B细胞可以由对所连接的类毒素的肽具有特异性的辅助性T细胞激活(图9.4)。
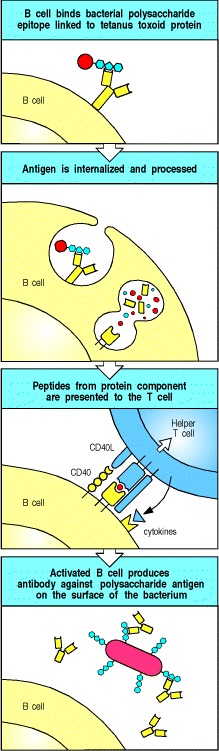
Figure 9.4 Protein antigens attached to polysaccharide antigens allow T cells to help polysaccharide-specific B cells
Haemophilus influenzae type B vaccine is a conjugate of bacterial polysaccharide and the tetanus toxoid protein. The B cell recognizes and binds the polysaccharide, internalizes and degrades the whole conjugate and then displays toxoid-derived peptides on surface MHC class II molecules. Helper T cells generated in response to earlier vaccination against the toxoid recognize the complex on the B-cell surface and activate the B cell to produce anti-polysaccharide antibody. This antibody can then protect against infection with H. influenzae type B.
链接识别最初是通过研究半抗原的抗体而发现的(请参阅附录I,A-1节)。 半抗原是很小的化学基团,因为它们不能交联B细胞受体,也不能募集T细胞帮助,因此无法自行引发抗体反应。 但是,当以高密度与载体蛋白偶联时,它们将具有免疫原性,因为该蛋白将携带多个现在可以交联B细胞受体的半抗原基团。 另外,T细胞依赖性应答是可能的,因为T细胞可以被引发来自该蛋白质的肽。 半抗原与蛋白质的结合是导致许多人对抗生素青霉素产生过敏反应的原因,青霉素与宿主蛋白质反应形成偶联的半抗原,可以刺激抗体反应,我们将在第12章中学习。
9-3 与自身MHC II类分子结合的抗原肽会触发武装的辅助性T细胞,形成能够激活B细胞的膜结合和分泌分子
武装辅助T细胞在识别B细胞表面适当的肽:MHC II类复合物时激活B细胞(图9.5)。与作用在巨噬细胞上的武装TH1细胞一样,识别B细胞上的II类肽:MHC复合物会触发武装辅助T细胞合成在激活B细胞中协同作用的细胞结合和分泌的效应分子。一个特别重要的T细胞效应分子是肿瘤坏死因子(TNF)家族的膜结合分子,称为CD40配体(CD40L,也称为CD154),因为它与B细胞表面分子CD40结合。 CD40是细胞因子受体TNF受体家族的成员(请参阅第8-20节),但它不包含“死亡结构域”。它参与了B细胞反应各个阶段的指导。 CD40L与CD40的结合有助于将静止的B细胞驱动进入细胞周期,对于B细胞对胸腺依赖性抗原的反应至关重要。
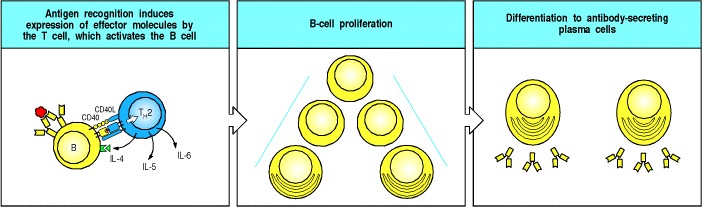
Figure 9.5Armed helper T cells stimulate the proliferation and then the differentiation of antigen-binding B cells
The specific interaction of an antigen-binding B cell with an armed helper T cell leads to the expression of the B-cell stimulatory molecule CD40 ligand (CD40L) on the helper T-cell surface and to the secretion of the B-cell stimulatory cytokines IL-4, IL-5, and IL-6, which drive the proliferation and differentiation of the B cell into antibody-secreting plasma cells.
当B细胞暴露于人工合成的CD40L和细胞因子白细胞介素4(IL-4)的混合物时,它们会在体外刺激增殖。当武装的TH2细胞识别其在B细胞表面的特异性配体时,它们也会由IL-4产生,并且IL-4和CD40L被认为在驱动体内抗体产生之前的克隆扩增中具有协同作用。 IL-4由TH2细胞以极性方式分泌,并定向在与B细胞接触的部位(图9.6),从而使其选择性地作用于抗原特异性靶B细胞。受体和CD40的连接,以及IL-4和其他直接T细胞接触产生的信号,会导致B细胞增殖。最近已经阐明了其中一些接触信号。它们涉及其他TNF / TNF受体家族成员,包括CD30和CD30配体以及BLyS(B淋巴细胞刺激物)及其在B细胞上的受体TACI。几轮增殖后,B细胞可以进一步分化为分泌抗体的浆细胞。辅助T细胞分泌的另外两种细胞因子IL-5和IL-6参与了B细胞活化的这些后期阶段。

Figure 9.6 When an armed helper T cell encounters an antigen-binding B cell, it becomes polarized and secretes IL-4 and other cytokines at the point of cell-cell contact
On binding antigen on the B cell through its T-cell receptor, the helper T cell is induced to express CD40 ligand (CD40L), which binds to CD40 on the B cell. As shown in the top left panel, the tight junction formed between the cells upon antigen-specific binding seems to be sealed by a ring of adhesion molecules, with LFA-1 on the T cell interacting with ICAM-1 on the B cell (see Fig. 8.30). The cytoskeleton becomes polarized, as revealed by the relocation of the cytoskeletal protein talin (stained red in right center panel), to the point of cell-cell contact, and the secretory apparatus (the Golgi apparatus) is reoriented by the cyto-skeleton toward the point of contact with the B cell. As shown in the bottom panels, cytokines are released at the point of contact. The bottom right panel shows IL-4 (stained green) confined to the space between the B cell and the helper T cell. MTOC, microtubuleorganizing center. Photographs courtesy of A. Kupfer.
9-4 同型转换需要辅助T细胞表达CD40L并由细胞因子指导
抗体不仅因其抗原结合位点的多样性而著称,而且作为效应分子的多功能性也很引人注目。 抗体反应的特异性由抗原结合位点决定,该位点由两个可变的V域VH和VL组成。 但是,抗体的效应作用取决于其重链C区的同种型(请参阅第4-15节)。 通过同种型转换过程,给定的重链V结构域可与任何同种型的C区关联(请参阅第4-16节)。 我们将在本章后面看到每种同种型的抗体如何促进病原体的消除。 在同种型转换基础上赋予这种功能多样性的体液免疫反应的DNA重排是由细胞因子指导的,尤其是由武装效应CD4 T细胞释放的那些。
所有幼稚的B细胞都表达细胞表面IgM和IgD,但IgM占血浆中免疫球蛋白的比例不到10%,其中最丰富的同种型是IgG。因此,血浆中的许多抗体是由经过同种型转换的B细胞产生的。任何时候几乎都不会产生IgD抗体,因此抗体应答的早期阶段主要由IgM抗体主导。后来,IgG和IgA是主要的同种型,其中IgE贡献了反应中很小但生物学上很重要的部分。 IgG的总体优势部分是由于其在血浆中的寿命更长(见图4.16)。
在缺乏功能性CD40L的个体中不会发生同种型转换(Isotype switching),这对于B细胞和辅助性T细胞之间的有效相互作用是必需的。这样的人在对胸腺依赖性抗原的应答中仅产生少量的IgM抗体,并且血浆中的IgM含量异常高(免疫学案例研究中的超级IgM免疫缺陷,请参见前言)。这些IgM抗体可能由长期感染这些患有严重体液免疫缺陷的患者的病原体,表达的胸腺非依赖性抗原诱导,我们将在第11章中看到。
关于通过辅助性T细胞调节同种型转换的大多数已知信息来自于实验,在实验中,小鼠B细胞被细菌脂多糖(LPS)和体外纯化的细胞因子刺激。这些实验表明,不同的细胞因子优先诱导转换为不同的同种型。这些细胞因子中的某些与在B细胞反应开始时驱动B细胞增殖的细胞因子相同。在小鼠中,IL-4优先诱导转换为IgG1和IgE,而转化生长因子(TGF)-β诱导转换为IgG2b和IgA。 TH2细胞同时产生这些细胞因子和IL-5,IL-5诱导已经经历转换的细胞分泌IgA。尽管TH1细胞是抗体应答的相对较差的引发剂,但它们通过释放干扰素(IFN)-γ参与同种型转换,后者优先诱导转换为IgG2a和IgG3。图9.7总结了细胞因子在指导B细胞产生不同抗体同种型中的作用。
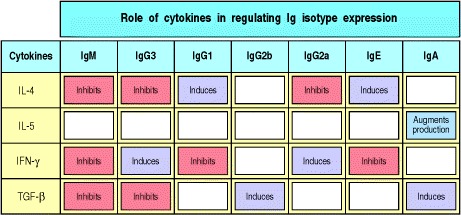
Figure 9.7 Different cytokines induce switching to different isotypes
The individual cytokines induce (violet) or inhibit (red) production of certain isotypes. Much of the inhibitory effect is probably the result of directed switching to a different isotype. These data are drawn from experiments with mouse cells.
细胞因子通过刺激从位于每个重链C基因5’的开关重组位点转录的mRNA的形成和剪接来诱导同种型转换(见图4.20)。例如,当激活的B细胞暴露于IL-4时,可以在转换发生前一两天检测到Cγ1和Cε转换区域上游位置的转录(图9.8)。最近的数据表明,剪接的开关转录本的产生在指导开关中起作用,但该机制尚不清楚。诱导转换的每种细胞因子似乎都诱导了来自两个不同重链C基因转换区域的转录,仅促进了与这些基因中一个或另一个的特异性重组。观察到这样的指导机制是,即使抗体重链仅从其中一个染色体表达,单个B细胞也经常在两个染色体上转换为相同的C基因。因此,辅助T细胞既调节由B细胞产生的抗体,又调节决定该抗体的效应子功能的同种型。

Figure 9.8 Isotype switching is preceded by transcriptional activation of heavy-chain C-region genes
Resting naive B cells transcribe the μ and δ genes at a low rate, giving rise to surface IgM and IgD. Bacterial lipopolysaccharide (LPS), which can activate B cells independently of antigen, induces IgM secretion. In the presence of IL-4, however, Cγ1 and Cε are transcribed at a low rate, presaging switches to IgG1 and IgE production. The transcripts originate before the 5′ end of the region to which switching occurs, and do not code for protein. Similarly, TGF-β gives rise to Cγ2b and Cα transcripts and drives switching to IgG2b and IgA. It is not known what determines which of the two trans-criptionally activated heavy-chain C genes undergoes switching. Arrows indicate transcription. The figure shows isotype switching in the mouse.
9-5 结合抗原的B细胞被困在次级淋巴组织的T细胞区域,并通过与武装的辅助性T细胞相遇而被激活
抗体反应的最令人困惑的特征之一是抗原特异性B细胞如何设法遇到具有适当抗原特异性的辅助性T细胞。之所以出现这个问题,是因为对任何给定抗原特异的幼稚淋巴细胞的频率估计在10,000到1,000,000之间。因此,识别相同抗原的T淋巴细胞和B淋巴细胞之间相遇的机会应介于1/10^8和1/10^12比之间。实现这种相遇比激活效应T细胞要困难得多,因为,在后一种情况下,所涉及的两个细胞中只有一个具有特异性受体。而且,T细胞和B细胞在外周淋巴组织中大部分占据相当不同的区域(见图1.8)。就像天真的T细胞激活一样(参见第8章),答案似乎在于迁移淋巴细胞的抗原特异性捕获。
将抗原引入动物后,会被专业的抗原呈递细胞(尤其是从组织迁移到局部淋巴结的T细胞区的树突状细胞)捕获并加工。再循环的天然T细胞连续经过这些细胞,并且非常有效地捕获其受体结合源自抗原的肽的那些稀有T细胞。这种捕获显然涉及到T细胞上的特定抗原受体,尽管它通过粘附分子和趋化因子的激活得以稳定,正如我们在第8-3和8-4节中所了解的那样。使用转基因的免疫球蛋白基因重排小鼠进行的巧妙实验表明,在存在适当抗原的情况下,具有抗原特异性受体的B细胞也通过类似的机制被捕获在淋巴组织的T细胞区中。遇到抗原时,通过结合分子的激活和趋化因子受体(如MCR-3β和SLC的受体CCR7)的结合,可阻止迁移的抗原结合B细胞被阻滞。
在T细胞区域中诱捕B细胞,为解决本节开头提出的问题提供了绝佳的解决方案。 T细胞本身在T细胞区中被捕获并激活为辅助状态,当B细胞通过高内皮小静脉迁移到淋巴组织中时,它们首先进入相同的T细胞区。大多数B细胞快速通过T细胞区域进入B细胞区域(初级卵泡),但是那些结合了抗原的B细胞却被捕获了。因此,将抗原结合B细胞选择性地精确地捕获在正确的位置,以最大程度地遇到可以激活它们的辅助性T细胞。与武装辅助T细胞的相互作用激活了B细胞,从而建立了克隆扩增的主要焦点(图9.9)。在这里,在T细胞和B细胞区域之间的边界处,两种类型的淋巴细胞都会增殖几天,以构成原发性体液免疫反应的第一阶段。
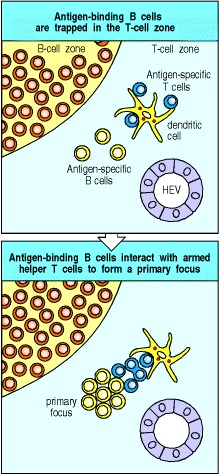
Figure 9.9 Antigen-binding cells are trapped in the T-cell zone
Upon entry into lymphoid tissues through a high endothelial venule (HEV), T cells and B cells home to different regions, as described in Chapter 7. Antigen-specific T cells remain in the T-cell zone provided that they encounter antigen on the surface of a antigen-presenting cell such as a dendritic cell. B cells normally move rapidly through the T-cell zone, unless they bind specific antigen, in which case they are trapped before leaving the T-cell zone and thus can interact with antigen-specific armed helper T cells. This interaction gives rise to a primary focus of B cells and T cells near the border between B-cell and T-cell zones.
几天后,扩散的主要焦点(primary focus )开始消失。构成焦点的许多淋巴细胞都发生凋亡。然而,一些增殖的B细胞分化成合成抗体的浆细胞并迁移到脾脏的红髓或淋巴结的髓索。 B细胞分化为浆细胞的过程中伴随着许多形态变化,这些变化反映了其对产生大量分泌抗体的承诺。在图9.10中比较了静止的B细胞和浆细胞的特性。浆细胞具有丰富的细胞质,主要由多层内质网构成(见图1.19)。核显示出外周染色质浓缩的特征模式,可见明显的核周高尔基体,内质网的池中富含免疫球蛋白,占所有合成蛋白的10–20%。 MHC II类分子不表达,因此浆细胞不能再向辅助T细胞呈递抗原,尽管这些T细胞仍可能为浆细胞的分化和存活提供重要信号,如IL-6和CD40L。表面免疫球蛋白仍以低水平在浆细胞上表达,最近的证据表明,浆细胞的存活可能部分取决于它们继续结合抗原的能力。浆细胞具有一定的寿命。一些在最终分化后仅能存活几天到几周,而另一些则寿命很长,并说明了抗体应答的持续性。
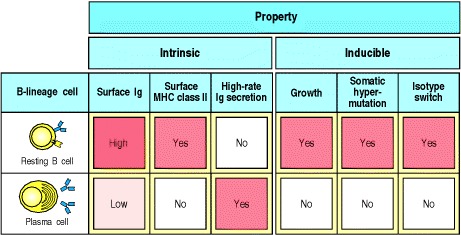
Figure 9.10 Plasma cells secrete antibody at a high rate but can no longer respond to antigen or helper T cells
Resting naive B cells carry surface immunoglobulin (usually IgM and IgD) and MHC class II molecules on their surface. Their V genes do not carry somatic mutations. They can take up antigen and present it to helper T cells, which then induce the B cells to proliferate, switch isotype, and undergo somatic hypermutation; however, B cells do not secrete significant amounts of antibody. Plasma cells are terminally differentiated B cells that secrete antibodies. They can no longer interact with helper T cells because they have very low levels of surface immuno-globulin and lack MHC class II molecules, although they have usually already undergone isotype switching and hypermutation. Plasma cells have also lost the ability to change isotype or to undergo further somatic hypermutation.
9-6 当活化的B细胞迁移到卵泡并增殖形成生发中心时,发生第二阶段的B细胞免疫应答
在主要病灶中增殖的某些B细胞和T细胞还有另一种命运。这些细胞中的一些迁移到初级淋巴滤泡(图9.11),在那里它们继续增殖并最终形成生发中心(germinal center)(图9.12)。生殖中心主要由增殖的B细胞组成,但抗原特异性T细胞约占生发中心淋巴细胞的10%,并为B细胞提供必不可少的帮助。生发中心本质上是一个细胞分裂岛,它位于初级卵泡中静息的B细胞海中。生发中心B细胞将静止的B细胞移向卵泡的周围,在中心周围形成静止细胞的覆盖区。原发性卵泡包含静息的B细胞,这些B细胞聚集在密集的过程网络周围,该过程从特殊的细胞类型(卵泡树突状细胞(FDC))开始延伸。卵泡树突状细胞通过分泌趋化因子BLC吸引幼稚和活化B细胞进入卵泡(参见第7-30节)。
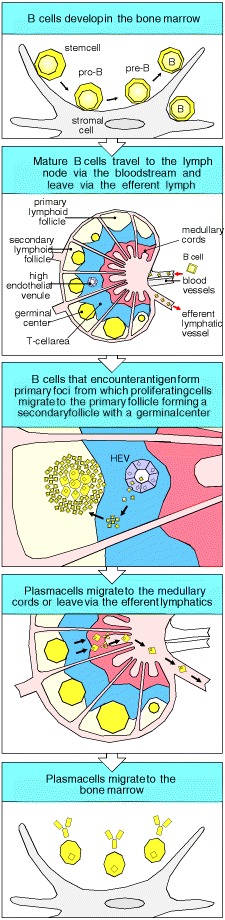
Figure 9.11 Activated B cells form germinal centers in lymphoid follicles
Some B cells activated in the primary focus migrate to form a germinal center within a primary follicle. Germinal centers are sites of rapid B-cell proliferation and differentiation. Follicles in which germinal centers have formed are known as secondary follicles. Within the germinal center, B cells commence their differentiation into either antibodysecreting plasma cells or memory B cells. Plasma cells leave the germinal center and migrate to the medullary cords or leave the lymph node altogether via the efferent lymphatics and migrate to the bone marrow. Memory B cells continue to recirculate through the B-cell zones of secondary lymphoid tissue (not shown) and some may preferentially reside in the splenic marginal zone as described in Chapter 7.
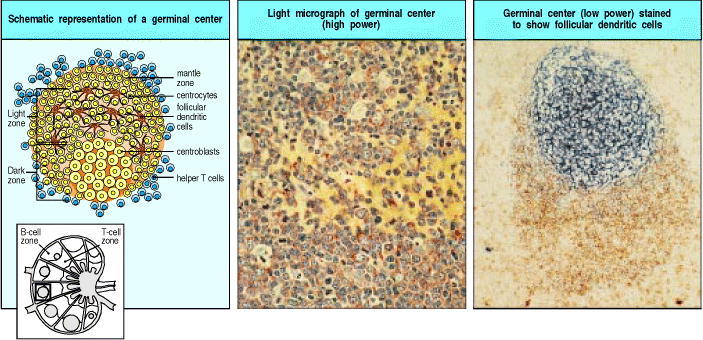
Figure 9.12 Germinal centers are formed when activated B cells enter lymphoid follicles
The germinal center is a specialized microenvironment in which B-cell proliferation, somatic hypermutation, and selection for antigen binding all occur. Rapidly proliferating B cells in germinal centers are called centroblasts. Closely packed centroblasts form the so-called ‘dark zone’ of the germinal center, as can be seen in the lower part of the center panel, which shows a section through a germinal center. As these cells mature, they become small centrocytes, moving out into an area of the germinal center called the ‘light zone’ (the upper part of the center panel), where the centrocytes make contact with a dense network of follicular dendritic cell (FDC) processes. The FDCs are not stained in the center panel but can be seen clearly in the right panel, where both FDCs (stained blue with an antibody against Bu10, an FDC-specific marker) in the germinal center and also the mature B cells in the mantle zone (stained brown with an antibody against IgD) can be seen. The plane of this section chiefly reveals the dense network of FDCs in the light zone, although the less dense network in the dark zone can just be seen at the bottom half of the figure below the intensely stained area. Photographs courtesy of I. MacLennan.
主要关注点的早期事件导致特定抗体的迅速分泌,该抗体可为受感染的个体提供即时保护。另一方面,如果病原体建立了慢性感染或宿主被再次感染,则生发中心反应可提供更有效的后期反应。为此,B细胞在生发中心进行了许多重要的修饰,包括体细胞超突变(请参阅第4章),它改变了B细胞的V区,亲和力成熟,从而选择了对B细胞具有高亲和力的B细胞存活。抗原和同种型转换(请参阅第9-4和4-16节),使这些选定的B细胞以不同同种型抗体的形式表达多种效应子功能。选定的B细胞将分化为记忆B细胞(其功能将在第10章中描述),或分化为浆细胞,其将在初次免疫反应的后期开始分泌更高亲和力和同种型转换的抗体。
生发中心(germinal center)是细胞强烈增殖的部位,B细胞每6至8小时分裂一次。最初,这些迅速增殖的B细胞会大大降低其表面免疫球蛋白(尤其是IgD)的表达。这些B细胞称为成核细胞。随着时间的流逝,一些B细胞降低了分裂速度,并开始表达更高水平的表面免疫球蛋白。这些被称为中心细胞(termed centrocytes)。首先,成纤维细胞在生发中心的暗区中增殖(见图9.12),这是因为增殖细胞是密集的。随着进一步的发展,B细胞开始填充生发中心的亮区,即卵泡的一个区域,该区域更富含卵泡状树突状细胞,而细胞密度较小。最初认为,只有暗区的成纤维细胞增殖,而亮区的中心细胞不分裂。确实,在通过手术切除的发炎扁桃体中发现的慢性生发中心可能就是这种情况。但是,现在在小鼠中新形成的生发中心中,很明显,增殖可以在亮区和暗区中发生,并且暗区中的增殖细胞可以在其表面表达适量的免疫球蛋白。因此,至少在小鼠中,暗区和亮区之间作为B细胞增殖或静止区域的区别并不严格适用于主要生发中心。最初在亮区最突出的滤泡树突状细胞似乎对生发中心的形成起反应,并随着生发中心的发展而开始在整个生发中心更加突出地延伸。结果是,免疫后第15天成熟的生发中心更像是亮区,几乎没有经典的暗区特征。正如我们现在所讨论的,这种对生发中心进化的看法可能有助于解释如何选择对免疫抗原具有高亲和力的B细胞。
9-7 生发中心(Germinal center )B细胞经历V区体细胞超突变,并选择具有改善对抗原亲和力的突变的细胞
在第4章中描述了体细胞高变过程,这是产生免疫球蛋白多样性的四种机制之一。在这里,我们描述了引发高变的信号以及这些细胞发生突变的生物学后果。体细胞超突变通常仅限于在生发中心中增殖的B细胞。这首先通过生发中心B细胞的FACS分选(见附录I,A-22部分)和从它们衍生的细胞系的V基因测序来证明。后来,通过对从组织学切片进行了显微解剖的生发中心B细胞中分离的DNA进行PCR扩增的V基因测序,更直接地显示了这一点。但是,体外研究表明,当B细胞的B细胞受体交联并且可以从活化的T细胞获得帮助,包括细胞因子和CD40L刺激时,就可以诱导B细胞在生发中心之外发生超突变。实际上,由于淋巴毒素-α基因突变(见第7-30节)而缺乏生发中心的小鼠仍支持B细胞超突变,尽管这种情况的发生地点尚不清楚。
与免疫球蛋白多样化的其他机制(请参阅第4-6节)不同,后者会产生具有根本不同的B细胞受体的B细胞,体细胞超突变可能会产生一系列相关的B细胞,这些B细胞的特异性和对抗原的亲和力有所不同。这是因为体细胞超突变通常涉及仅改变单个氨基酸的单个点突变。免疫球蛋白V区基因以每细胞分裂每10^3个碱基对约一个碱基对变化的速率积累突变。所有其他体细胞DNA的突变率要低得多:每细胞分裂每10^10个碱基对大约有一个碱基对变化。由于每个表达的重链和轻链V区基因均由约360个碱基对编码,并且每四个碱基的变化中约有三个导致氨基酸改变,因此,每隔B个细胞就会在其受体中获得一个突变在每个部门。这些突变也影响重排的V基因侧翼的某些DNA,但通常不会延伸到C区外显子。因此,随机点突变以某种方式针对B细胞中重新排列的V基因。
随着B细胞克隆在生发中心扩展,点突变逐步积累。通常,B细胞在每一代中不会获得一个或两个以上的新突变。突变会影响B细胞结合抗原的能力,因此会影响B细胞在生发中心的命运,如图9.13所示。大多数突变对B细胞受体结合原始抗原的能力有负面影响。例如,某些突变会通过引入阻止正确翻译的终止密码子来完全废除受体功能;其他有害突变会改变框架区氨基酸,这对于正确的免疫球蛋白折叠至关重要;还有一些在负责抗原接触的互补决定区改变氨基酸。这些有害的突变对于拥有它们的细胞是灾难性的。这些细胞通过凋亡而被清除,要么是因为它们不再能形成B细胞受体,要么是因为它们无法与结合抗原的同胞竞争。有害突变显然是一个经常发生的事件,因为生发中心充满了凋亡的B细胞,这些细胞迅速被巨噬细胞吞噬,形成了可染的身体巨噬细胞,其细胞质中含有深色染色的核碎片,并且是长久以来公认的生发中心的组织学特征。
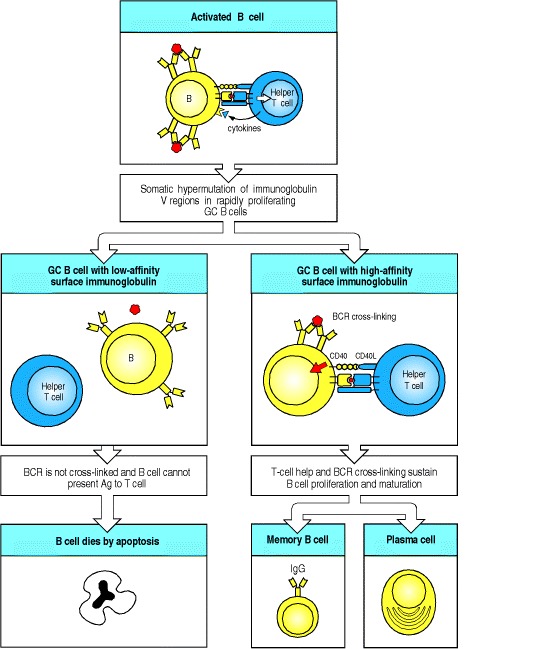
Figure 9.13After T-cell-dependent activation, B cells undergo rounds of mutation and selection for higher-affinity mutants in the germinal center, ultimately resulting in high-affinity memory B cells and antibody secreted from plasma cells
B cells are first activated outside of follicles by the combination of antigen and T cells (top panel). They migrate to germinal centers (GCs; not shown), where the remaining events occur. Somatic hypermutation can result in amino acid replacements in immunoglobulin V regions that affect the fate of the B cell. Mutations that result in a B-cell receptor (BCR) of lower affinity for the antigen (left panels) will prevent the B cell from being activated as efficiently, as both B-cell receptor cross-linking and the ability of the B cell to present peptide antigen to T cells are reduced. This results in the B cell dying by apoptosis. In this way, low-affinity cells are purged from the germinal center. Most mutations are either negative or neutral (not shown) and thus the germinal center is a site of massive B-cell death as well as of proliferation. Some mutations, however, will improve the ability of the B-cell receptor to bind antigen. This increases the B cell’s chance of interacting with T cells, and thus of proliferating and surviving (right panels). Surviving cells undergo repeated cycles of mutation and selection during which some of the progeny B cells undergo differentiation to either memory B cells or plasma cells (bottom right panels) and leave the germinal center. The signals that control these differentiation decisions are unknown.
突变很少会改善B细胞受体对抗原的亲和力。具有这些突变的细胞被有效地选择和扩增。这是否是由于防止细胞死亡和/或增强细胞分裂尚不清楚。无论哪种情况,显然选择都是增量的。每一轮突变后,B细胞开始表达新的受体,并决定细胞的命运,是有利还是不利。如果有利,细胞将经历另一轮分裂和突变,并重复表达和选择过程。以这种方式,在生发中心反应过程中,不断完善了阳性选择的B细胞的亲和力和特异性。母细胞和母细胞都可以增殖并表达免疫球蛋白,这一事实说明了在整个生发中心如何同时发生突变和阳性选择,而无需在暗区和亮区之间来回迁移。在通过生发中心幸存的B细胞V区中,体细胞超突变的模式中可以看到阳性和阴性选择的证据(请参阅第4-9节)。负选择的存在由构架区中氨基酸替换的相对稀缺来表明,反映出已经丢失了对免疫球蛋白V区折叠至关重要的许多残基中的任何一个突变的细胞的损失。负选择是生发中心的重要力量,极有可能消除每两个细胞中的一个。如果不是为了进行实质性的阴性选择,每天在一个生发中心分裂三到四次的B细胞会迅速产生足够的后代,以淹没整个生物体。一个生发中心在10天之内可以创建超过10亿个细胞。相反,生发中心实际上在其峰值处包含数千个B细胞。
另一方面,阳性选择的标志是互补决定区中大量氨基酸置换的积累(见图4.9)。 这些在生发中心发生的增殖,突变和选择循环的结果是,响应的B细胞群体对其抗原的平均亲和力会随着时间的推移而增加, 在很大程度上解释了观察到的抗体应答亲和力成熟的现象。 选择过程可能非常严格:尽管50到100个B细胞可以播种发芽中心(germinal center),但大多数细胞都不会留下后代,并且当发芽中心达到最大大小时, 它通常仅由一个或几个B细胞的后代组成。
9-8 B细胞受体和CD40的连接,以及与T细胞的直接接触,都需要维持生发中心B细胞
生发中心B细胞天生就容易死亡,为了生存,它们必须接收特定的信号。 最初在体外发现,生发中心B细胞可以通过同时交联其B细胞受体并连接其细胞表面CD40来保持存活。 在体内,这些信号分别通过抗原和T细胞传递。 生存还需要其他信号,这些信号是通过与T细胞直接接触传递的。 这些信号的性质仍然不清楚,但是最近发现一种涉及TNF家族成员BLyS(T细胞信号)和TACI(其B细胞受体)的信号系统对于维持生发中心至关重要。
生发中心的抗原来源一直存在一些争议。抗原可以以免疫复合物的形式被捕获并长期保存在滤泡树突状细胞中(图9.14和9.15),因此可以认为这是维持生发中心B细胞增殖的抗原。尽管这在某些情况下可能是正确的,但现在有证据表明,不需要卵泡树突状细胞上的抗原来维持正常的生发中心反应。确实,尽管这些抗原库可以维持长寿的浆细胞,但其在这些细胞上的作用尚不清楚。维持生发中心的抗原从何而来?在正常情况下,最有可能将活病原体携带到淋巴组织中并在淋巴组织中繁殖,直到细菌被免疫反应消除后,生发中心才会腐烂。蛋白质抗原的免疫通常以随着时间的推移缓慢释放抗原的形式进行,这类似于活病原体的情况。确实,如果没有活复制病原体或佐剂中抗原的持续释放,很难通过免疫刺激刺激生发中心的形成(见附录I,A-4节)。
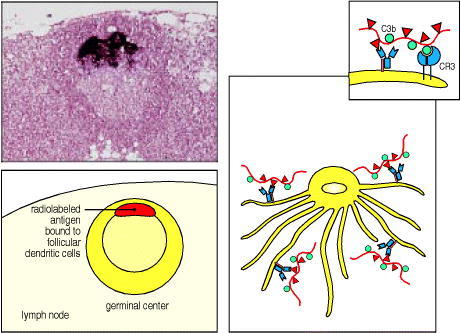
Figure 9.14 Immune complexes bind to the surface of follicular dendritic cells
Radiolabeled antigen localizes to, and persists in, lymphoid follicles of draining lymph nodes (see light micrograph and the schematic representation below, showing a germinal center in a lymph node). Radiolabeled antigen has been injected 3 days previously and its localization in the germinal center is shown by the intense dark staining. The antigen is in the form of antigen:antibody:complement complexes bound to Fc and complement receptors on the surface of the follicular dendritic cell. These complexes are not internalized, as depicted schematically for immune complexes bound to both Fc and CR3 receptors in the right panel and insert. Antigen can persist in this form for long periods. Photograph courtesy of J. Tew.
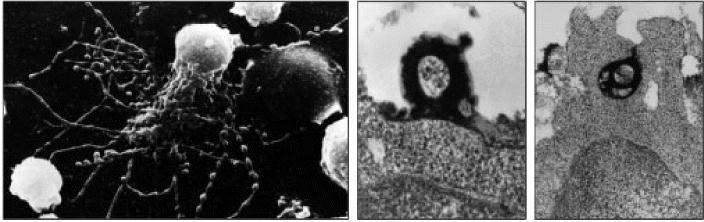
Figure 9.15 Immune complexes bound to follicular dendritic cells form iccosomes, which are released and can be taken up by B cells in the germinal center
Follicular dendritic cells have a prominent cell body and many dendritic processes. Immune complexes, bound to complement and Fc receptors on the follicular dendritic cell surface, become clustered, forming prominent ‘beads’ along the dendrites. An intermediate form of follicular dendritic cell is shown (left panel) with both straight filiform dendrites and those that are becoming beaded. These beads are shed from the cell as iccosomes (immune complexcoated bodies), which can bind (center panel) and be taken up by B cells in the germinal center (right panel). In the center and right panels, the iccosome has been formed with immune complexes containing horseradish peroxidase, which is electrondense and thus appears dark in the transmission electron micrographs. Photographs courtesy of A.K. Szakal, Annual Reviews of Immunology 1989; 7:91-109.
维持生发中心的各种信号如何对B细胞发挥作用尚不完全清楚。 来自B细胞受体和CD40的组合信号似乎上调了一种称为Bcl-XL的蛋白质,Bcl-2的亲戚,它促进B细胞存活(请参阅第6章)。 毫无疑问,还有许多其他信号可以促进B细胞分化。
9-9 存活的生发中心B细胞分化为浆细胞或记忆细胞
生发中心反应的目的是增强初级免疫反应的后期。一些生发中心细胞首先分化为浆母细胞,然后分化为浆细胞。成纤维细胞继续迅速分裂,但已开始专长以高速率分泌抗体。它们注定会成为不可分裂的终末分化浆细胞,因此代表了分化的中间阶段。这些浆细胞将迁移到骨髓,在那里它们的一部分会长期生存。浆细胞从骨髓基质细胞获得对其存活必不可少的信号。这些浆细胞提供了持久的高亲和力抗体来源。
其他生发中心细胞分化为记忆B细胞。记忆B细胞是细胞的长寿命后代,曾经被抗原刺激并已在生发中心增殖。这些细胞分裂的速度非常慢。它们表达表面免疫球蛋白,但不高水平分泌抗体。由于记忆B细胞的前体曾经参与生发中心反应,因此记忆B细胞会继承发生在生发中心细胞中的遗传变化,包括体细胞突变和导致同种型转换的基因重排(请参阅第4-9和第4节) 16)。目前尚不清楚控制B细胞采取哪种分化途径,以及B细胞是否在任何给定点继续分裂而不分化的信号。
已经提出,来自卵泡树突状细胞(FDC)的信号在刺激B细胞成为记忆细胞方面很重要。 但是,记忆细胞可以在缺乏FDC的突变小鼠中发育,尽管效率降低,因此可能存在其他信号源。 另一种可能性是对抗原的亲和力控制B细胞分化,其中高亲和力细胞可能优先被刺激成为记忆细胞,而低亲和力细胞则被允许经历进一步的增殖,突变和选择循环。 这只是免疫学家尚未解决的生发中心的奥秘之一。 免疫记忆将在第10章中详细讨论。
9-10 B细胞对具有激活B细胞固有能力的细菌抗原的反应不需要T细胞帮助
尽管对大多数蛋白质抗原的抗体反应依赖于辅助性T细胞,但具有T细胞缺陷的人和小鼠仍会产生针对许多细菌抗原的抗体。这是因为某些细菌多糖,聚合物蛋白和脂多糖的特殊性质使它们能够在缺乏肽特异性T细胞帮助的情况下刺激幼稚B细胞。这些抗原被称为胸腺非依赖性抗原(TI抗原),因为它们在无胸腺个体中刺激强烈的抗体反应。这些非蛋白质细菌产物无法引发经典的T细胞反应,但它们会在正常个体中诱导抗体反应。但是,对这些TI抗原的B细胞反应受T细胞的存在影响,可能间接受细胞因子(如IL-5)影响,因为它们在完全没有T细胞的动物中大大降低了。
胸腺非依赖性抗原分为两类,它们通过两种不同的机制激活B细胞。 TI-1抗原具有可以直接诱导B细胞分裂的内在活性。在高浓度下,这些分子会导致大多数B细胞的增殖和分化,无论其抗原特异性如何。这称为多克隆激活(图9.16,顶部两幅)。因此,TI-1抗原通常被称为B细胞有丝分裂原,一种有丝分裂原是一种诱导细胞经历有丝分裂的物质。 B细胞有丝分裂原和TI-1抗原的一个例子是LPS,它与LPS结合蛋白和CD14结合(请参阅第2章),然后与B细胞上的受体TLR-4结合。 LPS仅以比激活树突状细胞所需剂量大100倍以上的剂量激活B细胞。因此,当B细胞暴露于TI-1抗原的浓度比多克隆激活所用的浓度低103-105倍时,只有那些B细胞受体也特异性结合TI-1分子的B细胞才被激活。在如此低的抗原浓度下,仅借助于这种特异性结合,才能将足够量的TI-1用于B细胞活化浓缩在B细胞表面(图9.16,底部两幅)。在大量TI-1抗原的存在下,不需要这种浓缩作用,并且可以刺激所有B细胞。
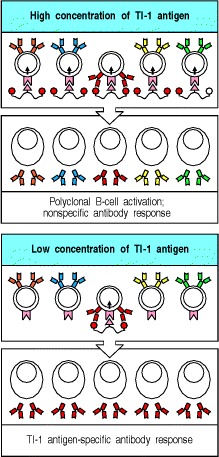
Figure 9.16 Thymus-independent type 1 antigens (TI-1 antigens) are polyclonal B-cell activators at high concentrations, whereas at low concentrations they induce an antigen-specific antibody response
At high concentrations, the signal delivered by the B-cell-activating moiety of TI-1 antigens is sufficient to induce proliferation and antibody secretion by B cells in the absence of specific antigen binding to surface immunoglobulin. Thus, all B cells respond (top panels). At low concentrations, only B cells specific for the TI-1 antigen bind enough of it to focus its B-cell activating properties onto the B cell; this gives a specific antibody response to epitopes on the TI-1 antigen (lower panels).
与任何病原体抗原一样,在体内感染的早期阶段,TI-1抗原的浓度可能很低。 因此,只有抗原特异性B细胞才可能被激活,并且它们将产生对TI-1抗原具有特异性的抗体。 这样的反应在抵抗几种细胞外病原体中起着重要作用,因为它们比胸腺依赖性反应更早出现,因为它们不需要事先进行辅助T细胞的引发和克隆扩增。 但是,TI-1抗原不能有效诱导同种型转换,亲和力成熟或记忆B细胞,所有这些都需要特定的T细胞帮助。
9-11 B细胞对细菌多糖的反应不需要肽特异性T细胞帮助
第二类不依赖胸腺的抗原由具有高度重复结构的分子(例如细菌荚膜多糖)组成。这些不依赖胸腺的抗原称为TI-2抗原,不具有内在的B细胞刺激活性。 TI-1抗原可以激活未成熟B细胞和成熟B细胞,而TI-2抗原只能激活成熟B细胞。如第7章所述,未成熟的B细胞被重复的抗原决定簇灭活。这可能就是为什么婴儿不能有效地产生针对多糖抗原的抗体的原因。他们的大多数B细胞均未成熟。对几种TI-2抗原的反应在B-1细胞(也称为CD5 B细胞)中很明显,B-1细胞包括B细胞的一个自主复制的亚群,在边缘区域B细胞中,另一种非循环B细胞的独特子集位于B细胞脾脏白髓的边界(见第7章)。尽管B-1细胞在发育早期出现,但幼儿直到5岁才对碳水化合物抗原做出完全有效的反应。另一方面,边缘区的B细胞在出生时很少见,并且随着年龄的增长而积累。因此,它们可能是大多数生理性TI-2反应的原因,并且随着年龄的增长而增加。
TI-2抗原很可能通过广泛交联对该抗原具有特异性的成熟B细胞的B细胞受体发挥作用(图9.17,左图)。然而,过多的受体交联使成熟的B细胞无反应或无反应,就像未成熟的B细胞一样。因此,表位密度似乎对TI-2抗原激活B细胞至关重要:密度太低时,受体交联不足以激活细胞。如果密度过高,B细胞将变得无能为力。
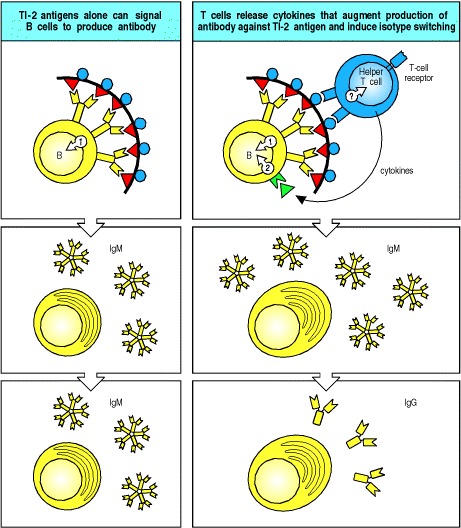
Figure 9.17 B-cell activation by thymus-independent type 2 antigens (TI-2 antigens) requires, or is greatly enhanced by, cytokines
Multiple cross-linking of the B-cell receptor by TI-2 antigens can lead to IgM antibody production (left panels), but there is evidence that helper T cells greatly augment these responses and lead to isotype switching as well (right panels). It is not clear how T cells are activated in this case, because polysaccharide antigens cannot produce peptide fragments that might be recognized by T cells on the B-cell surface. One possibility is that a component of the antigen binds to a cell-surface molecule common to all helper T cells, as shown in the figure. Another possibility (not shown) is that certain γ:δ T cells or CD4 CD8 double-negative α:β T cells can provide help, as some of these cells have T-cell receptors that recognize certain polysaccharrides bound to unconventional MHC molecules such as CD1.
尽管对TI-2抗原的应答可在裸鼠(无胸腺)中发生,但通过敲除TCRβ和TCRδ基因座来耗尽所有T细胞,可消除对TI-2抗原的应答。 此外,可以通过将少量T细胞转移到这些T细胞缺陷小鼠体内来增强对TI-2抗原的反应。 T细胞如何促进TI-2反应尚不清楚。 一种可能性是T细胞可以通过所有T细胞共有的细胞表面分子识别TI-2抗原并被TI-2抗原激活(图9.17,右图)。 或者,帮助可能来自γ:δT细胞或CD4 CD8双阴性α:βT细胞。 这些细胞上的T细胞受体识别与非常规MHC I类或I类分子(例如CD1)结合的某些多糖。 这样的T细胞可以在胸腺外,主要在肠内发育。
B细胞对TI-2抗原的反应可对重要的病原体提供迅速而具体的反应。许多常见的细胞外细菌病原体被多糖囊包围,使它们能够抵抗吞噬细胞的摄入。细菌不仅逃脱了吞噬细胞的直接破坏,而且避免了巨噬细胞通过细菌肽的呈递而刺激T细胞反应。在不借助肽特异性T细胞的情况下,针对这种多糖胶囊快速产生的抗体可以覆盖这些细菌,并通过我们将在本章稍后介绍的机制促进吞噬细胞对它们的摄取和破坏。常见的封装细胞外细菌通常被称为化脓性细菌,因为它们通常会引起大量脓液的形成,脓液主要由已被募集到感染部位的死亡和垂死的中性粒细胞组成。 IgM和IgG抗体均由TI-2抗原诱导,可能是许多细菌感染中体液免疫反应的重要组成部分。前面我们提到了针对这种细菌的保护性免疫力,即针对TI-2抗原的B型流感嗜血杆菌荚膜多糖的抗体的重要性。 TI-2应答重要性的另一个例子可以在患有免疫缺陷病(称为Wiskott-Aldrich综合征)的患者中看到(Image Immunity_small.jpg Wiskott-Aldrich Syndrome,在《免疫学案例研究》中,请参见前言)。这些患者尽管对蛋白质抗原的反应较差,但不能产生针对多糖抗原的抗体,并且极易感染被包埋的细菌。因此,TI应答是对不参与肽特异性T细胞帮助的非蛋白质抗原的体液免疫应答的重要组成部分。图9.18总结了胸腺依赖性,TI-1和TI-2抗体应答的区别特征。
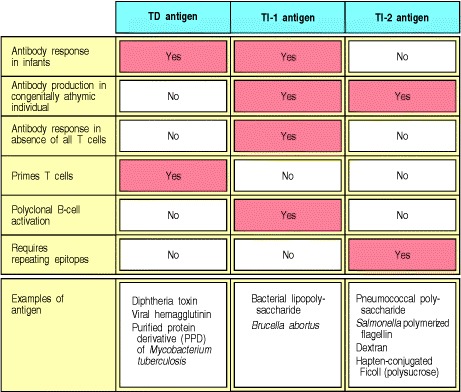
Figure 9.18 Properties of different classes of antigen that elicit antibody responses
总结
许多抗原(尤其是单体蛋白)对B细胞的激活既需要B细胞表面免疫球蛋白(即B细胞受体)与抗原的结合,又需要B细胞与抗原特异性辅助性T细胞的相互作用。辅助T细胞识别源自B细胞内在的抗原的肽片段,并被B细胞展示为肽:MHC II类复合物。辅助T细胞通过T细胞上的CD40L与B细胞上的CD40结合,通过其他TNF-TNF-受体家族配体对的相互作用以及定向释放的细胞因子来刺激B细胞。最初的相互作用发生在次级淋巴组织的T细胞区域,由于结合抗原,抗原特异性和辅助性T细胞以及抗原特异性B细胞均被捕获。 T细胞和B细胞之间的进一步相互作用是在迁移到B细胞区域或卵泡并形成生发中心之后发生的。辅助性T细胞诱导一个阶段性的B细胞增殖,并指导幼稚B细胞的克隆扩增后代分化为分泌抗体的浆细胞或记忆B细胞。在活化的B细胞分化过程中,抗体同种型可以响应辅助性T细胞释放的细胞因子而改变,并且抗体的抗原结合特性可以通过V区基因的体细胞超突变而改变。体细胞超突变和高亲和力结合的选择发生在生发中心。辅助性T细胞通过选择性激活保留了其对抗原特异性的细胞并诱导增殖和分化为浆细胞和记忆B细胞来控制这些过程。在没有肽特异性辅助性T细胞连锁识别的情况下,一些非蛋白质抗原会刺激B细胞。这些不依赖胸腺的抗原仅诱导有限的同种型转换,而不诱导记忆B细胞。但是,对这些抗原的应答在宿主防御其表面抗原不能引起肽特异性T细胞应答的病原体中起着至关重要的作用。
参考资料
