【7.8.6.2】CD33
CD33(cluster of differentiation 33,分化簇 33)
1. 靶点机制(图2、3)
CD33 又称氨基肽酶 N(aminopeptidase N,APN),分子量为 67kD,是一种糖基化单 通道跨膜蛋白,是唾液酸结合超家族的成员,称为唾液酸结合免疫球蛋白样凝集素 3 (Siglec 3)。在分化过程中,成熟粒细胞上 CD33 水平降低,但在巨噬细胞、单核细胞和 树突状细胞上保留。在交联或者配体结合后激活,介导抑制信号,调节细胞内钙动员、细 胞黏附、白血病细胞凋亡、髓系细胞成熟和细胞因子的产生等。它具有调节固有免疫系统 细胞中的作用,研究亦支持通过与糖蛋白(2,6-唾液酸连接子)的低亲和力结合在自我与 非自我识别中发挥作用。唾液酸结合是通过 V-set Ig 结构域(离细胞表面最远的区域)完 成。另一个细胞外 CD33 的组成部分是 C2-set Ig 结构域(位于 V-set Ig 结构域和细胞表面 之间)。CD33 也拥有一种基于酪氨酸的细胞内免疫受体抑制性模体(ITIM)和一个类似 ITIM 的用于介导由具有 V-set IG 结构域与细胞外配体相互作用的信号的结构域。
CD33 在非造血组织中的表达有限,但在急性髓系白血病(acute myeloid leukemia, AML)细胞中高表达。此外,现已证实在白血病祖细胞也表达 CD33,使该分子成为一个 非常有潜力的 AML 的治疗靶点。
2. 临床研究申报概况
在 ADC 中,Gentuzumab ozogamicin(GO)是人 IgG4 CD33 单克隆抗体(hP67.6)偶 联 calicheamicin 衍生物,曾在 2000 年就获得 FDA 批准(第一款获批的 ADC 药物),不 过后期辉瑞公司因该产品的安全性和在临床试验中缺乏临床效益,于 2010 年撤回,然后 以较低的给药剂量对 GO 进行重新设计临床试验(在第 1、4、7 天给予 GO 诱导剂量为 3mg/m2,之前是在第 1 和 14 天为 9mg/m2),降低了肝静脉闭塞性疾病和早期死亡风险, 2017 年 9 月 FDA 重新批准了 GO 上市,批准用于成人新确诊的 CD33 阳性 AML、成人 复发/难治性 AML 和 2 岁及儿科患者的 AML。IMGN779 是 CD33 单克隆抗体偶联 indolinobenzodiazeprine pseudodimers(烷化剂),它进行了一项临床研究(NCT02674763), 没有发生剂量限制毒性(dose limiting toxicities,DLT),初步结果显示该药安全有效。国 内 ADC 临床试验正在进行,如评估注射用 DXC007(重组人源化抗 CD33 单抗-Tub255 偶 联剂)在复发/难治性 AML 患者中的安全性、耐受性、药代动力学特征的开放、多中心、 首次人体、剂量递增和扩大入组的I期临床研究。
单克隆抗体药物 BI 836858 是全人 IgG1 抗 CD33 抗体,增强与 FcɣRIIIa 的结合,以 加强其 ADCC 活性。Phase1b 的初步结果报告了 31 例接受 BI836858 治疗的情况,5 例患 者获得完全缓解/完全反应,另有 4 例达到无白血病状态。双特异性抗体包括 AMG330 (Amgen),一种 CD33/CD3 双特异性 T 细胞接合(BiTE)抗体结构,将细胞毒性 T 细胞 导向到 CD33 表达的 AML 细胞,杀死靶细胞。临床前研究显示该药有效,目前进入I期 临床研究(NCT02520427)。强生的 BiTE JNJ-67371244 也进入I期临床研究 (NCT03915379);AMV564(Amphivena Therapeutics),CD33/CD3 双抗,采用了 Tandem 技术,分子量 106kD,半衰期 8.72~19.2 小时。对复发/难治性 AML 患者进行了 1、3+3 剂量爬坡研究。初步结果显示,19 名患者持续静脉输液超过 14 天,未见 DLTs 或治疗相 关等级≥3 不良事件。在 100μg/d 的队列中,1 例患者获得完全缓解,1 例部分缓解,2 例疾病稳定。目前研究还在进行(NCT03144245:Study of AMV564 in Patients With AML)。
三特异性抗体(TriKE)包括 161533 TriKE(CD16/IL-15/CD33),通过靶向 CD33 阳性的 肿瘤细胞以及 CD33 髓系衍生抑制细胞(MDSC),增强 NK 细胞功能,诱导靶向 CD33 的 抗肿瘤反应。目前正在进行I/II期临床研究,NCT03214666,GTB-3550(CD16/IL-15/CD33) Tri-Specific Killer Engager (TriKETM) for High Risk Heme Malignancies。
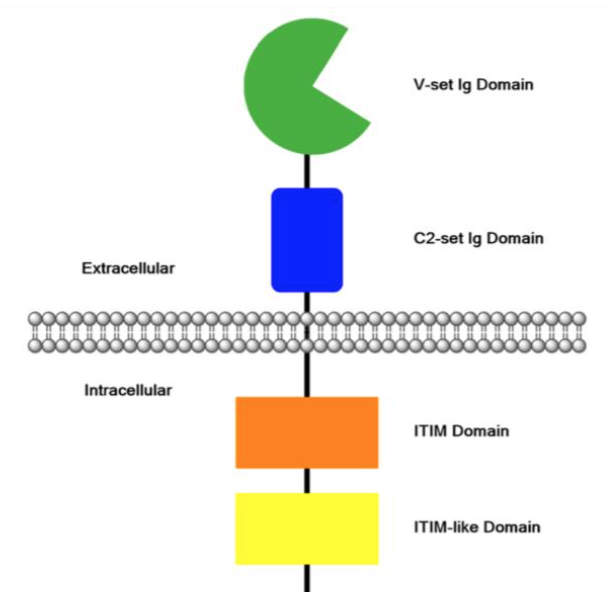
图2 人CD33/Siglec3蛋白结构示意图 注:胞外唾液酸敏感结构域包含 V-set Ig 结构域(绿色)和 C2-set Ig 结构域(蓝色)。细胞内 CD33/Siglec 3 的信号启动子是 ITIM 结构域(橙色)和 ITIM 样域(黄色)。
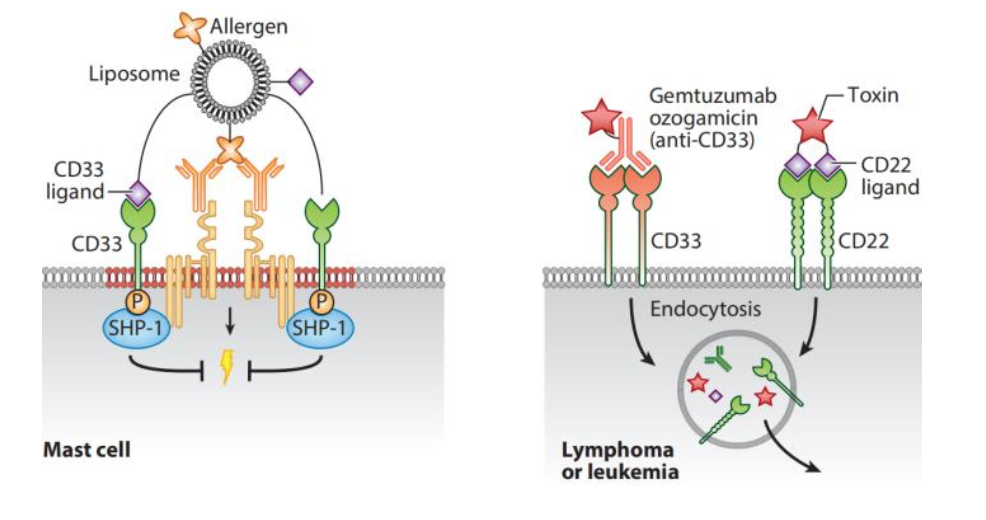
图3 靶向Siglecs以调节疾病中免疫细胞反应的实例
注:左图显示 IgE-FcεRI 复合体采用脂质体招募 CD33(Siglec3),进而过敏原和 CD33 配体抑制肥大 细胞活化并对随后的过敏原激发脱敏。右图显示用与抗体或多糖结合的毒素靶向内吞的 Siglec 治疗淋 巴瘤/白血病细胞。
资料来源:
- Zhao L.CD33 in Alzheimer’s Disease:Biology,Pathogenesis,and Therapeutics:A Mini-Review[J]. Gerontology, 2019,65,323−331. 4
- Naj AC,Jun G,Beecham GW,et al.Common variants at MS4A4/MS4A6E,CD2AP,CD33 and EPHA1 are associated with late-onset Alz¬heimer’s disease[J].Nat Genet,2011,43:436–441.
- Duan S,Paulson J C.Siglecs as Immune Cell Checkpoints in Disease[J].Annual Review of Immunology, 2020,38(1),365–395.
3. 简评
CD33 作为 AML 的潜力靶点,无论是对该靶点有布局的企业,还是 CD33 靶向药物的 种类,都在不断拓展。从最初的化疗、造血干细胞移植,到后来的 ADC、双抗药物、三抗 以及 CAR-T 细胞治疗,以及到现在的 CAR-NK 细胞治疗。来自西部战区总医院刘芳团队 开发的 CLL1-CD33 双靶点 CAR-T 细胞治疗,在治疗 AML 时显示出积极的疗效。尽管患 者出现了不同程度的并发症,且有 8 例患者都出现了细胞因子风暴(CRS),但经过积极的 治疗和用药,所有患者的并发症都得到有效控制,没有患者发生治疗死亡事件。除此之外, 国内的南京传奇、河北森朗,以及国外的 iCell Gene Therapeutics 等企业均有布局靶向 CD33 的 CAR-T 细胞治疗研发管线,且进展都在临床I期和II期阶段,竞争较为激烈。
参考资料
- 《2022年度中国抗肿瘤新药临床研究评述》
