【1.1】脂质纳米颗粒制剂简介(LNP)
如果没有对基于脂质的药物递送 (LBDD, lipid-based drug delivery) 进行数十年的研究,基于 mRNA 的 COVID-19 疫苗就不可能取得成功。LBDD 系统用途广泛,已用于将各种生物活性分子(如小分子抑制剂和疫苗成分)递送至目标细胞和组织。与传统药物递送方法相比,LBDD 具有几个优点,包括:
- 增加药物稳定性
- 生物利用度
- 分布。
脂质纳米颗粒 (LNP) 是 LBDD 系统的一个子集,在提供基于寡核苷酸的治疗方面取得了重大进展。包裹在 LNP 中的寡核苷酸在递送过程中受到保护,不会被酶降解,并被有效地递送至细胞,在细胞中货物被释放并转化为治疗性蛋白质。鉴于 LNP 具有彻底改变基于寡核苷酸的疗法的巨大潜力,新一波的研究人员正在寻求 LNP 的个人应用。在这里,我们介绍了常见的 LBDD 系统的基本原理及其交付的货物,重点是 LNP。这一背景为理解 LNP 为何以及如何传递寡核苷酸奠定了基础。然后,我们介绍了准备 LNP 的基本概念和程序,包括:
- 设计(Design)
- 制备和混合(Preparation and mixing)
- 稳定性和存储(Stability and storage)
- 表征(Characterization)
- 验证(Validation )
一、基本概念
1.1 核心概念
-
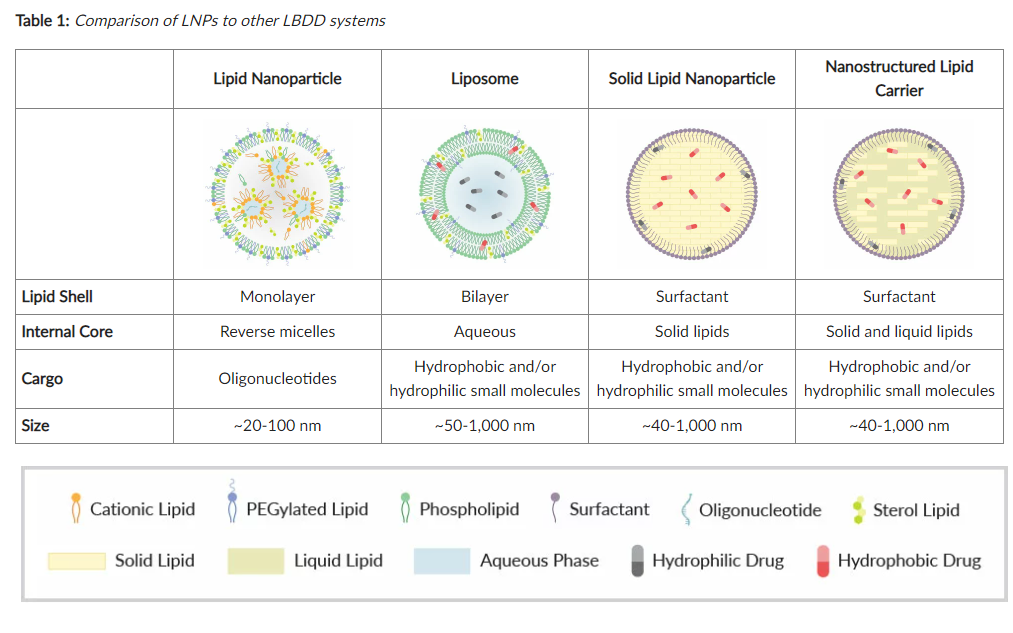
脂质纳米颗粒 (LNP,Lipid nanoparticles ): 围绕内部核心的脂质壳,由反胶束组成( reverse micelles),反胶束封装和传递寡核苷酸,如 siRNA、mRNA 和质粒 DNA (pDNA)(表 1)。
-
脂质体(Liposomes): 含有一个或多个脂质双层(lipid bilayers)和一个水核(aqueous core)。它们按层状和尺寸进一步分类。脂质体可用于递送疏水性和/或亲水性小分子。
-
固体脂质纳米颗粒 (SLN,Solid lipid nanoparticles ): 表面活性剂壳,围绕由固体脂质组成的核心基质。它们用于包封疏水和/或亲水货物。
-
纳米结构脂质载体 (NLC,Nanostructured lipid carriers): 表面活性剂壳,围绕由固体和液体脂质组成的核心基质。它们用于包封疏水和/或亲水货物。
-
胶束(Micelles): 脂质单层在水溶液中的自组装。它们有一个疏水核心,其中磷脂尾朝向内部,可用于封装小的疏水货物。
-
反胶束(Reverse micelles): 与传统胶束相比的倒置结构。它们形成亲水核心,磷脂尾部朝向外部,可用于封装小的亲水货物,如 LNP 中的寡核苷酸。
1.2 结构件
LNPs 通常由甘油磷脂、阳离子脂质、甾醇脂质和聚乙二醇化脂质组成,寡核苷酸包含在水相中。LNP 中使用的许多相同结构成分是其他 LBDD 粒子的成分。脂质和包含它们的分子(如表面活性剂)可用于调整 LBDD 颗粒的行为和特性。因此,在 LBDD 颗粒配制过程中,结构成分的选择非常重要。
-
甘油磷脂(Glycerophospholipids) 是一类磷脂,它包含一个亲水性头基和两个与甘油主链相连的疏水性脂肪酰基尾。亲水性头部决定了 LBDD 颗粒的电荷,它可以是中性的、阴离子的(负的)或阳离子的(正的)。
- 中性磷脂(Neutral phospholipids)有助于膜融合的功效,也可用于分布或改变脂质颗粒的净表面电荷。总带中性电荷的磷脂头基是 磷脂酰胆碱 (PC)和 磷脂酰乙醇胺 (PE)。
- 阴离子脂质(Anionic lipids)通常用于小分子的输送,并结合到中性 LBDD 系统中以防止储存期间的聚集。磷脂酰甘油 (PG)、 磷脂酰肌醇 (PI)、 磷脂酰丝氨酸 (PS)和 磷脂酸 (PA)是含有阴离子头基的磷脂。
-
阳离子脂质(Cationic Lipids) 对于寡核苷酸包封是有效的,但它们与不良的细胞毒性有关。开发了可电离的阳离子脂质来规避这个问题。这些脂质具有在低 pH 值(通常 <7)下获得的瞬时阳离子电荷,形成反胶束,将寡核苷酸封装在 LNP 核心中。由于这些脂质在生理 pH 值下具有接近中性的电荷,因此它们有效地递送寡核苷酸货物而没有细胞毒性。可电离阳离子脂质有五种主要结构类别,它们对 RNA 递送和毒性有不同的影响:不饱和、多尾、分支尾、聚合和可生物降解的可电离脂质(unsaturated, multi-tail, branched-tail, polymeric, and biodegradable ionizable lipids)。可从 Cayman 获得的可电离阳离子脂质及其 pK a值可在本文末尾找到。
-
甾醇脂质(Sterol Lipids),例如胆固醇,用于填充脂质膜包装缺陷并提供结构完整性。它们还有助于 LNP 和靶细胞的膜融合。胆固醇通常占 LBDD 配方的 20-50%。
-
聚乙二醇化脂质(PEGylated Lipids) 可防止血清蛋白吸附,抑制单核吞噬细胞系统 (MPS) 的摄取,这 是 LBDD 系统体内递送的主要障碍。一些聚乙二醇化脂质还含有末端官能团,例如 胺或 马来酰亚胺,可用于缀合其他改善细胞靶向和摄取的分子。
-
水相(Aqueous Phase) 脂质成分溶解疏水性货物,而水相溶解亲水性分子,如 LNP 中的寡核苷酸和脂质体中的亲水性药物。
-
表面活性剂(Surfactants )是 SLN 和 NLC 脂质壳的主要成分。由于它们的两亲性质,它们降低了亲脂核和水相之间的界面张力,并提高了储存期间的稳定性。含有 磷脂酰胆碱的卵磷脂是一种已用于 SLN 和 NLC 的表面活性剂。
-
固体脂质(Solid lipids),俗称脂肪,在环境温度下为固体,用于制备 SLN 和 NLC。用于制备 SLN 或 NLC 的固体脂质通常是饱和的,包括 甘油脂以及 硬脂酸。
-
液体脂质(Liquid lipids),也称为油,在环境温度下是流体。NLC 由固体和液体脂质的混合物配制而成,可增加载药能力并防止药物泄漏。NLC 中使用的液体脂质通常是不饱和的,包括 油酸、 α-生育酚和 角鲨烯。
1.3 货物 Cargo
LNP 更适合寡核苷酸的包封,而其他 LBDD 系统更适合小分子抑制剂或脂质的递送。您的应用所需的 LBDD 系统取决于货物,而货物在 LBDD 颗粒中的定位取决于其物理化学性质。
-
寡核苷酸(Oligonucleotides) mRNA、siRNA 和 pDNA 是常见的寡核苷酸货物。寡核苷酸带负电荷,最好使用可电离的阳离子脂质包裹在 LNP 中。含有 mRNA 的 LNP 是几种 COVID-19 疫苗的基础,含有转甲状腺素蛋白靶向 siRNA 的 LNP 已被开发用于治疗遗传性淀粉样蛋白转甲状腺素 (ATTRv) 淀粉样变性。
-
小分子 疏水和/或亲水小分子可以分别溶解在脂质体、SLN和NLC的水性或亲脂性隔室中。
- 疏水性药物(Hydrophobic Drugs)分散在整个 LBDD 系统的亲脂性隔室中。 两性霉素 B(一种抗真菌剂)和 维替泊芬(一种光敏剂)是 FDA 批准的已在脂质体中配制的疏水性药物的例子。
- 亲水性药物(Hyrophilic Drugs)溶解在 LBDD 系统的水性隔室中。 阿霉素是一种抗肿瘤抗生素,是一种亲水性药物。Doxil ®是一种封装在脂质体中的阿霉素,是第一个获得 FDA 批准的 LBDD 制剂。
-
脂质(Lipid) 脂肪酸、甘油单酯和其他生物活性脂类也可以加入到 LBDD 系统中。 月桂酸、 亚油酸或 油酸已在小鼠模型中掺入具有杀菌活性的脂质体中。含有单甘酯甘油单月桂酸酯和抗菌肽的 LBDD 系统在体外和体内对 金黄色葡萄球菌 也有活性。 C6 神经酰胺是一种鞘脂,已被输送到癌细胞,在那里它具有促凋亡活性。
二、LNP 设计
在选择脂质以及如何将它们制成 LNP 时,应考虑几个因素。下面,我们概述了这些因素以及它们中的每一个如何影响 LNP 颗粒的生理行为。
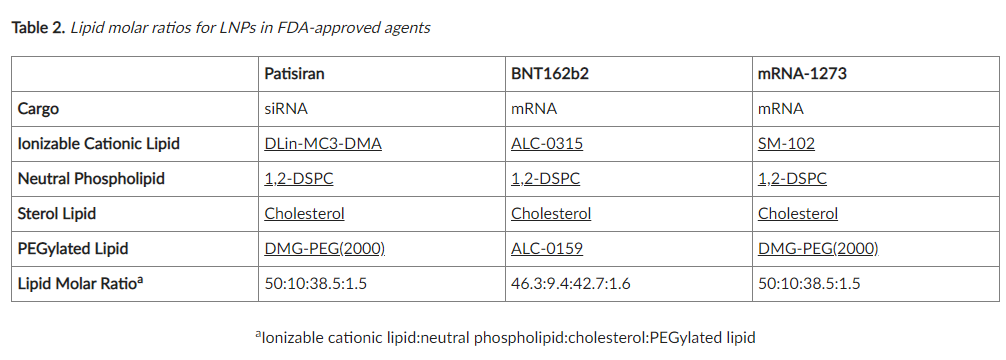
脂质摩尔比决定了颗粒的脂质组成并影响它们的大小、多分散性和功效( size, polydispersity, and efficacy)。我们建议从文献综述开始,以确定以前为类似应用开发的脂质摩尔比。FDA 批准的 LNP 的脂质摩尔比如下(表 2):
-
脂质:寡核苷酸的 重量比影响包封(encapsulation )效率。大多数 LNP 的脂质:寡核苷酸重量比为 10:1。
-
可电离的脂质氮:寡核苷酸磷酸 (N:P)摩尔比,表示可电离的阳离子脂质的阳离子叔胺与寡核苷酸骨架中的阴离子磷酸基团之间的电荷平衡。该特性是可电离阳离子脂质与寡核苷酸络合的基础。LNPs 通常具有 N:P 比率大约 6 。
-
脂肪酸解离常数 (lipid pKa ),是脂质的离子化和非离子化形式以相等浓度存在时的 pH 值。脂质 pK a影响 LNP 的封装效率、功效、递送和毒性。对于 RNA 递送,脂质 pK a通常范围为 6-7。已确定不同给药途径的特定范围。静脉内和肌肉内给药的最佳脂质 pK a范围分别为 6.2-6.6 和 6.6-6.9。
-
水性缓冲液(Aqueous Buffer)的三个重要参数, 是其组成、离子强度和 pH 值。缓冲液稳定溶液中的寡核苷酸,可电离的阳离子脂质在混合后在酸性水缓冲液中质子化并带正电荷。LNP 制剂中常用的缓冲液是 25-50 mM 乙酸钠或柠檬酸钠,pH 4-5。LNP 被透析到中性缓冲液中,例如 PBS,pH 7.4,用于储存和使用。
-
粒径(Particle size),会改变给药颗粒的药代动力学。 较小的颗粒通常具有较长的循环半衰期,因为它们逃避 MPS 的消除。小于 100 nm 的颗粒可以很容易地穿过有孔的内皮以穿透目标组织。粒度取决于制备方法。根据 LNP 的制备方法,可以使用挤出来获得更小、更均匀的粒径。
-
两种最常用的LNPs给药途径(routes of administration), 是静脉注射和肌肉注射。静脉内给药的 LNP 主要分布于肝脏和脾脏,但也分布于肺。具有净正电荷、中性电荷和负电荷的 LNP 可分别靶向肺、肝和脾。在制剂中加入胆固醇或聚乙二醇化脂质,以及增加 LNP 大小,增加了脾脏的分布。肌肉注射通常用于疫苗,因为它有助于淋巴结靶向和免疫反应的激活。当接种疫苗时,抗原呈递细胞 (APC),如巨噬细胞和树突状细胞,被招募到递送部位,在那里它们可以遇到疫苗抗原。然后它们迁移到淋巴结,在那里刺激 T 细胞反应。值得注意的是,针对给定给药途径优化的制剂通常不适用于其他给药途径。
-
制备方法(Preparation method)决定了 LNPs 的性质,包括尺寸、均匀性和封装效率。 在选择制备方法时,还应考虑成本、可扩展性、可重复性和时间承诺。 铁汉 16:33:41 在下面的部分中,我们给出了一系列用于生产 LNP 的简单协议。涵盖了 LNP 生命周期的整个范围,从实验室制备 LNP 开始,到如何使用 LNP 以及 在体外或 体内实验中使用 LNP 时的预期结果。
三、LNP 准备
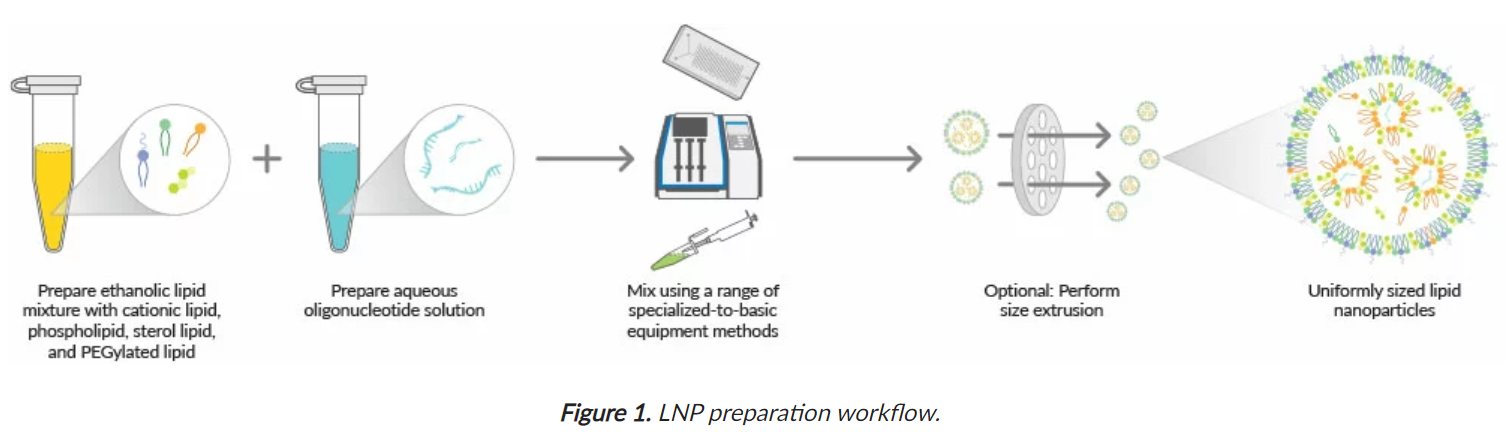
开始之前,请确保所有耗材、试剂和工作环境均不含 RNase。siRNA 和 mRNA 在化学上对 RNase 不稳定,RNase 是降解基于 RNA 的寡核苷酸的酶。图 1总结了 LNP 形成的步骤 。
四、混合
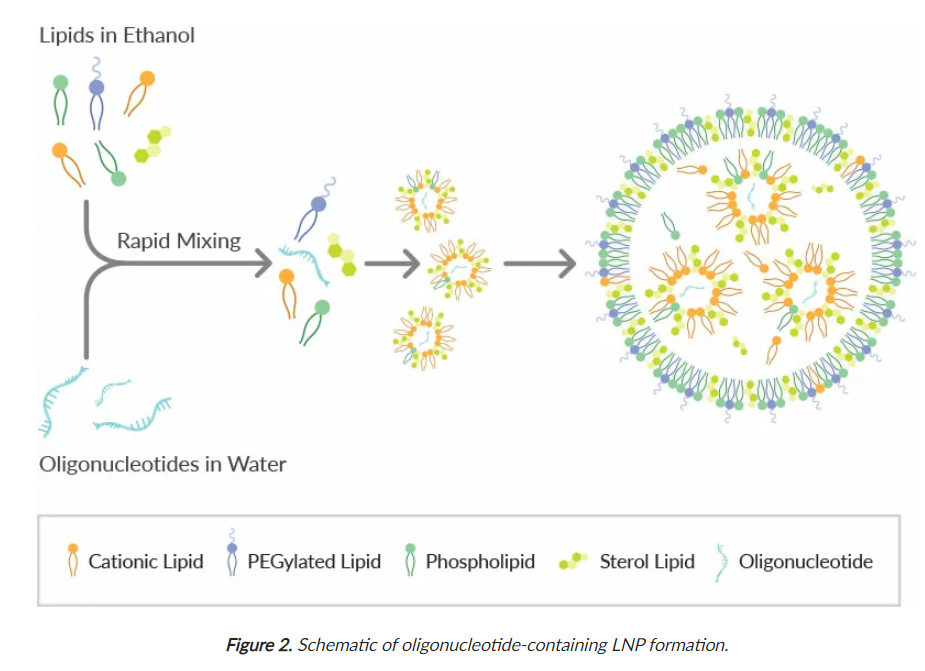
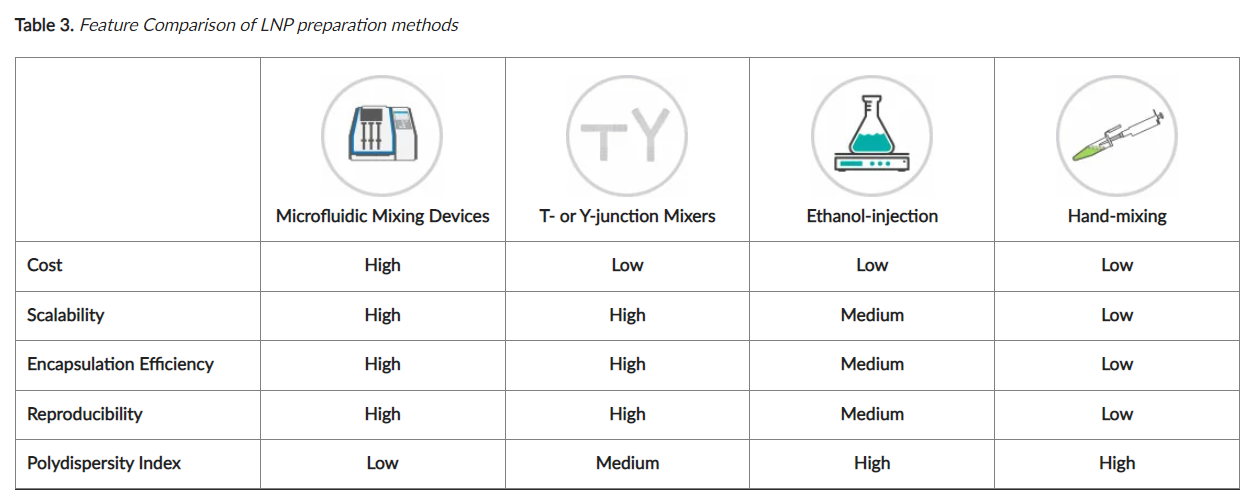
LNP 是通过将乙醇脂质混合物与含有寡核苷酸的酸性水缓冲液混合来制备的(图 2)。通常使用 1:3 的乙醇脂质混合物与水性缓冲液的比例。有几种方法适用于实验室规模的小批量 LNP 生产。这些方法中的四种适用于一系列从专业到基本的设备,在下面和 表 3中进行了简要比较。
-
微流控混合设备:自动化微流控设备或微流控芯片是制备 LNP 的快速有效的方法。这些设备能够以高度可控、可重复的方式快速混合,从而实现均匀的 LNP 和高封装效率。在这些装置中,乙醇脂质混合物和寡核苷酸水溶液的各个流快速组合。LNPs 在两种流混合时形成,并被收集到单个收集管中。可以更改流量比和总流量等参数以微调 LNP。
-
T 形或 Y 形接头混合器:这些混合器可以使用普通且廉价的实验室材料组装。T 型或 Y 型连接器可以配备两个入口,该入口连接到含有脂质混合物或寡核苷酸溶液的单个注射器,一个出口将 LNP 引导到收集管中。可选地,入口流速可以用注射泵控制。
-
乙醇注射:所有实验室都可以使用这种方法。借助磁力搅拌板进行乙醇脂质混合物和寡核苷酸水溶液的混合。在不断搅拌下将乙醇脂质混合物注入酸性寡核苷酸水溶液中并继续混合 30 分钟。这种方法可能会产生更多异质的 LNP,但封装效率较低,并且容易发生变异。
-
手动混合:这是乙醇注射的一种更简单的替代方法。将乙醇脂质混合物转移到酸性寡核苷酸水溶液中,通过快速移液器混合 15 秒。让混合物静置 10 分钟。与乙醇注射法一样,手动混合 LNP 会导致非均相 LNP 的封装效率低,并且会产生可变的结果。
最终准备(Preparation)
LNP 的最终制备是在混合步骤中形成后进行的。以下步骤有助于确保 LNP 在储存和使用过程中均质、稳定,并且不含任何残留的化学或生物污染物。
-
挤出(Extrusion)可减小粒度并产生均匀的粒度分布。此步骤通常使用批量混合方法进行,例如乙醇注射和手动混合方法。
-
透析(Dialysis) 使用适当的分子量截止 (MWCO) 管对存储缓冲液中的 LNP 进行透析。此步骤从最终制剂中去除未封装的货物、多余的脂质成分和乙醇。透析还将 LNP 的 pH 值从酸性制备缓冲液调整为中性储存溶液。
-
过滤除菌(Filter Sterilize) 过滤是 LNP 灭菌的推荐方法。储存前使用 0.22 µm 过滤器对 LNP 进行过滤消毒,以去除细菌或其他污染物。对于较大的颗粒或高粘度溶液,可以使用其他灭菌方法,例如高压灭菌或辐照,尽管这些方法可能会影响 LNP 的结构完整性。
五、稳定性和存储 Stability & Storage
在准备好 LNP 后,它们可以立即使用或储存以备后用。下面,我们将讨论在存储期间可能损害 LNP 解决方案完整性的因素,并提供有关如何限制存储不稳定性的提示。
物理稳定性(Physical Stability)描述了 LNP在储存过程中的结构完整性。粒子融合或聚集,以及封装货物的泄漏是物理不稳定的例子。
- 确保尺寸分布保持小而均匀:在 LNP 配方中使用阴离子或聚乙二醇化脂质以防止颗粒融合/聚集
- 防止货物泄漏:在 LNP 配方中加入胆固醇
- 遵循存储要求:调整储存温度、缓冲液和 pH 值 2)避免冻融循环
化学稳定性 定义了 LNP 脂质和货物成分对其分子结构修改的抵抗力。水解、氧化和酯交换可导致寡核苷酸和脂质降解或脂质-寡核苷酸加合物的形成和功效丧失。
- 限制货物降解:
- 使用无 RNase 试剂和耗材
- 考虑具有抗降解的糖磷酸骨架修饰的寡核苷酸货物
- 防止脂质氧化:
- 在储存期间加入抗氧化剂,如 α-生育酚,或冷冻保护剂,如海藻糖或蔗糖
- 遵循存储要求:
- 调整储存温度、缓冲液和 pH 值
- 避免冻融循环
生物稳定性 与 LNP 避免被 体外 或 体内 系统早期降解的能力有关。有助于生物稳定性的因素包括脂质组成、粒度和表面电荷。
- 减少血清蛋白调理作用:
- 包括聚乙二醇化脂质
- 减小粒径
- 实现接近中性的 zeta 电位
- 增加 LNP 亲水性
- 减少早期货物泄漏:
- 遵循存储要求
- 使用可电离的阳离子脂质
- 加入长的和/或不饱和的脂质
- 在 LNP 配方中加入胆固醇
储存 是LNP 制剂稳定性的关键参数。
- 通常,LNP 可以在 4°C 下储存长达 1 周,或者,对于长期储存,冻干并保持在 -80°C。储存温度、缓冲液和 pH 值可能需要优化。建议在有或没有冻干的情况下加入冷冻保护剂。
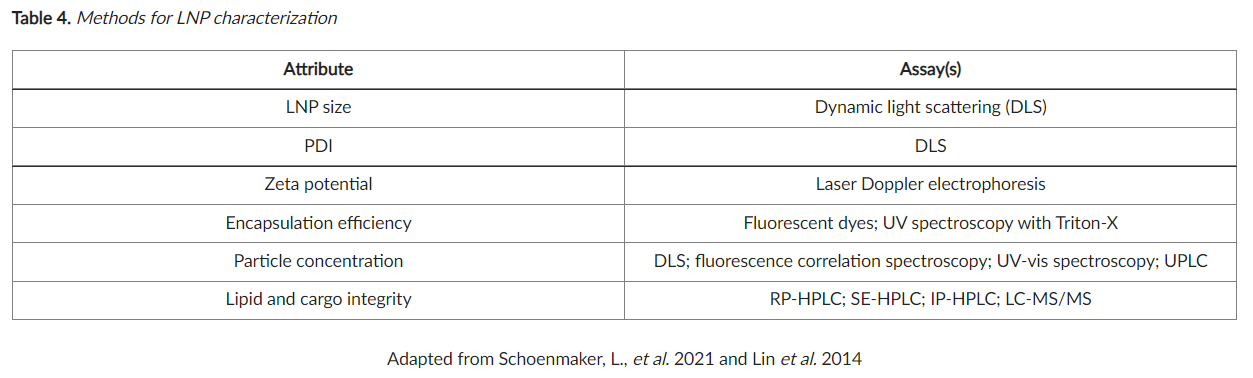
六、表征(Characterization)
在体外或 体内使用之前表征 LNP 属性 对于重现性至关重要。有关适合 LNP 表征的分析方法, 请 参见表 4 。
-
LNP 大小描述了 LNP的平均直径。LNP 大小影响生物分布和细胞摄取,从而影响 LNP 功效。多 分散指数 (PDI)是 LNP 尺寸分布的量度。均质、尺寸均匀的样品具有较小的 PDI,而具有不均匀尺寸分布的样品具有较大的 PDI。LNP 制剂的 LNP 大小和 PDI 可以通过优化脂质成分、提高混合速率、选择不同的制备方法或添加挤出步骤来降低。
-
Zeta 电位是 LNP 周围的静电势。通常,接近中性的 zeta 电位是可取的。阴离子 LNP 可能会被带负电荷的质膜静电排斥,而阳离子 LNP 可能具有细胞毒性。zeta 电位可以通过改变 N:P 来调整。
-
封装效率(Encapsulation efficiency)是 LNP 中所含寡核苷酸的量与混合期间使用的起始量相比。微流体混合方法产生最高的封装效率。
-
粒子浓度(Particle Concentration)的量化对于确保实验之间的可比结果是必要的。或者,可以确定脂质和 RNA 成分的最终浓度。LNPs 可以通过超速离心浓缩或根据需要稀释。
-
脂质和货物的完整性(Lipid and Cargo Integrity)对于 LNP 的功效和稳定性至关重要。有关详细信息,请参阅下面的存储和稳定性部分。我们的 化学合成团队提供脂质表征服务。
七、验证(Validation)
LNPs 通过内吞作用被靶细胞内化。 内体逃逸(Endosomal escape)是内吞作用后 LNP 货物被输送到胞质溶胶的过程。可电离的阳离子脂质在内体腔的酸性环境中变得质子化并带正电荷,这会破坏带负电荷的内体膜并促进封装的寡核苷酸货物释放到细胞质中,在那里发生翻译。
-
可以通过简单的分子生物学技术在体外确认 LNP 的功效 。感兴趣的基因或蛋白质的敲低或表达的测量可以分别 通过qPCR 或 蛋白质印迹来完成。基于细胞的报告基因检测也用于确定 LNP 功效。
-
体内寡核苷酸产物的蛋白质表达 遵循靶标依赖性时间过程。编码功能性蛋白质的封装寡核苷酸会在数小时内产生蛋白质浓度的变化,而那些编码旨在引发抗体反应的货物的寡核苷酸可能会在几天到几周之间发生。由于寡核苷酸易于降解,因此通常需要使用重复给药方案来实现持续的蛋白质表达。ELISA 和多重检测可用于测量靶蛋白和抗体反应,以及细胞因子和趋化因子浓度,从而深入了解 LNP 的免疫原性和耐受性。
-
给药后 LNP的 命运取决于脂质组成、LNP 设计和给药途径。静脉内给药后,LNPs 通常分布到肝脏和脾脏。肌肉内给药旨在靶向淋巴结,但经常诱导局部和远端(例如,肝脏)蛋白表达。因此,在这些相同的组织中可检测到 LNP 中使用的脂质。LNPs 中使用的脂质具有生物相容性和快速降解性,通常在给药后 24 至 48 小时内消除。为了确定脂质组织浓度,可以使用基于质谱的方法。
参考资料
- An Introduction to Lipid Nanoparticle Formulation: Basic Concepts & Preparation Procedures。https://www.caymanchem.com/news/intro-to-lipid-nanoparticle-formulation
