【9.21】免疫系统和免疫疗法
一、 免疫系统介绍
所有生物体的共同特征之一是能够抵御其生活环境中的挑战。哺乳动物具有复杂的防御系统,可以抵御细菌、病毒和寄生虫,它们构成了免疫系统。免疫系统可以非常广泛地表征为有两个主要分支: 先天免疫 和 适应性免疫.
- 先天免疫系统是抵御病原体的“第一道防线”,包括巨噬细胞和树突状细胞,它们的部分功能是将抗原呈递给适应性免疫系统中的细胞。
- 免疫系统的适应性臂由淋巴细胞介导,对病原体具有更高的特异性。适应性免疫系统的关键细胞是 1)辅助性 T 细胞 (Th),它们表达一种称为 CD4 的标记物、2)由 CD8 标记物区分的细胞毒性 T 淋巴细胞 (CTL) 和 3)产生抗体的 B 细胞。
被 T 细胞和 B 细胞识别的病原体的分子成分被广泛地称为抗原。
适应性免疫系统已经进化为对与各种外来病原体的初次接触以及与同一病原体的潜在二次接触作出反应。这些挑战塑造了免疫系统的发展,使其具有多样性、特异性和记忆性。
- 多样性使个体能够对多种可能的病原体做出反应,
- 同时对特定病原体的元素产生精细的特异性,确保对给定病原体的集中反应,同时最大限度地减少对宿主组织的附带损害。
- 记忆是免疫系统对先前遇到的病原体做出快速反应的能力,从而避免生病并在不损害宿主的情况下快速清除致病生物。
免疫系统的另一个特点是它通常不会攻击宿主自身的组织。这种对“自我”与“非自我”的认识以及避免攻击自身组织的能力被称为 自我容忍。尽管这些耐受机制对于避免自身免疫至关重要,但它们是抗肿瘤免疫中需要克服的障碍
2 先天免疫
2.1 抗原呈递
先天免疫系统的主要功能之一是将抗原呈递给适应性免疫系统,以协调功能性免疫反应。树突状细胞 (DC) 是高度特化和高效的抗原呈递细胞 (APC)。将 DC 与其他“专业”APC(如巨噬细胞和 B 细胞)区分开来的一个关键功能是它们激活幼稚 T 细胞的能力。抗原通过主要组织相容性复合体 (MHC) 分子呈递给 T 细胞。
MHC 由一系列由高度多态性共显性表达基因编码的蛋白质组成。因此,每个个体都表达了个体之间不同的特定 MHC 等位基因组合,并且种群中存在巨大的多样性。MHC分子有两种主要类型。
- MHC I 类分子几乎在所有细胞上都有表达。
- MHC II 类分子主要在 APC 上表达,例如巨噬细胞、DC 和 B 细胞,或者仅在炎症的情况下才能被诱导在细胞上表达。
小鼠 MHC I 类分子被称为 H-2K、H-2D 和 H-2L;小鼠 MHC II 类分子是 IA 和 IE。
人类 MHC 由 3 个 I 类分子 HLA-A、HLA-B 和 HLA-C 和 3 个 II 类分子 HLA-DQ、HLA-DP 和 HLA-DR 组成。
- I 类异源二聚体包含与非多态性 β2-微球蛋白蛋白 (β2m) 非共价结合的跨膜 α-链。。
- II 类 MHC 分子在细胞表面表达为 α 和 β 异源二聚体。MHC I 类和 II 类分子的 示意图如图 21-1 所示。
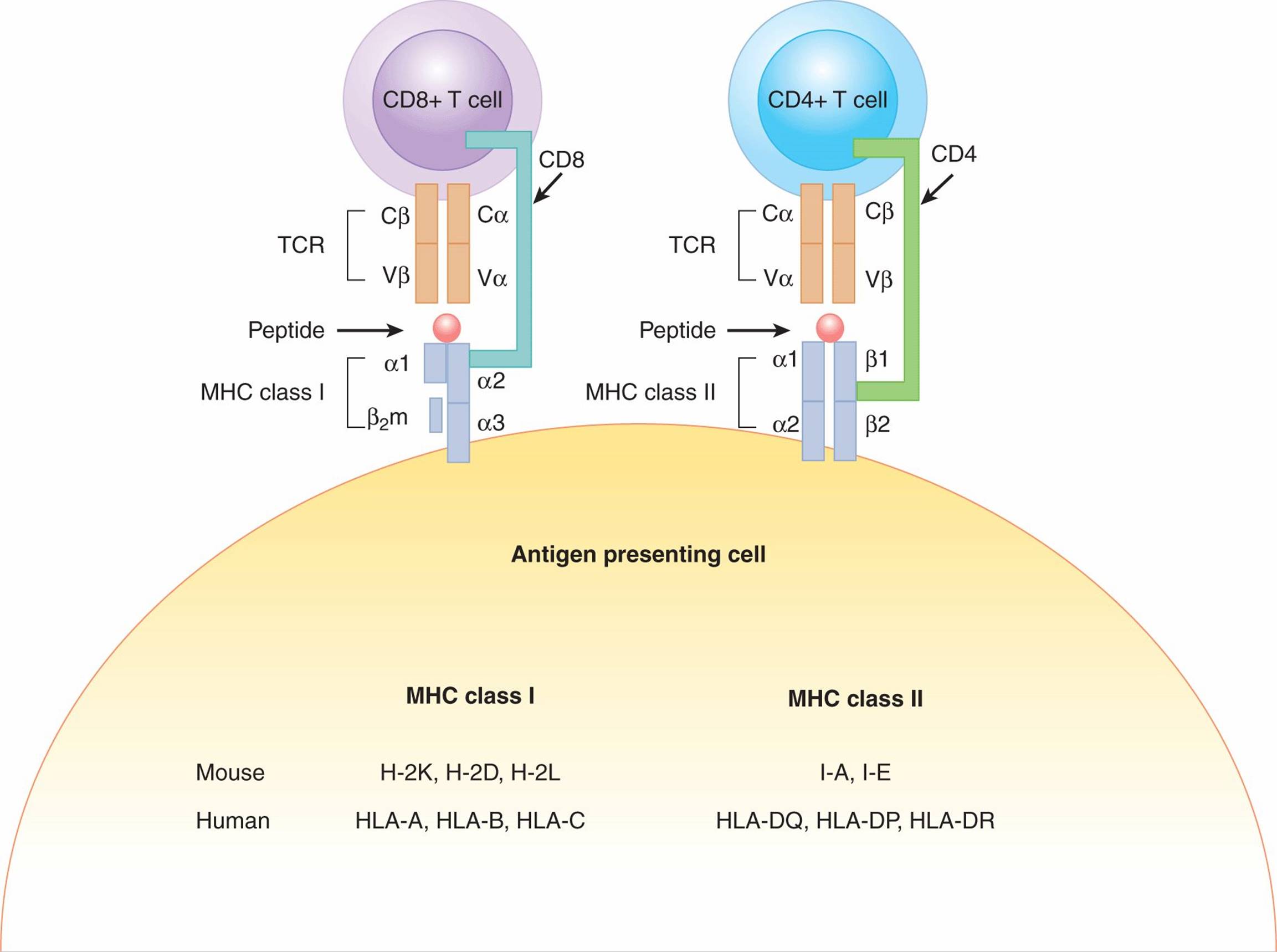
图 21–1 在 MHC 分子的背景下,T 细胞识别抗原。T 细胞受体 (TCR) 的 α/β 二聚体识别抗原呈递细胞 (APC) 表面的肽片段。CD4+ T 细胞上的 TCR 结合带有抗原肽的 MHC II 类分子。这种相互作用通过来自 CD4+ T 细胞表面的 CD4 辅助受体与 MHC II 类分子结合而得到稳定。CD8+ T 细胞上的 TCR 结合带有抗原肽的 MHC I 类分子。这种相互作用由 CD8 辅助受体稳定。人和小鼠中 MHC 等位基因的命名列在图的底部。β 2 m,β 2 -微球蛋白。
MHC I 类和 II 类分子的功能是结合和展示用于 T 细胞识别的肽片段。这些肽可能来自自身蛋白质或外源蛋白质。MHC 分子的肽结合裂缝包含分子内多态性最高的区域,并影响可能结合的肽阵列。I 类和 II 类的不同之处在于可以结合裂缝的肽的大小。MHC I 类结合较小的肽片段(8 到 11 个氨基酸),而 II 类呈现较大的蛋白质片段(15 到 18 个氨基酸)。
肽可以被加工并加载到 MHC 分子结合间隙的 3 条主要途径被称为外源性、内源性和交叉呈递途径。这些通路 如图 21-2 所示。外源性途径是 II 类加载的主要途径,而通过内源性和交叉呈递途径加工的蛋白质导致 I 类加载。内源性途径发生在大多数细胞中,而其他 2 条途径(外源性和交叉呈递)主要发生在 APC 中。
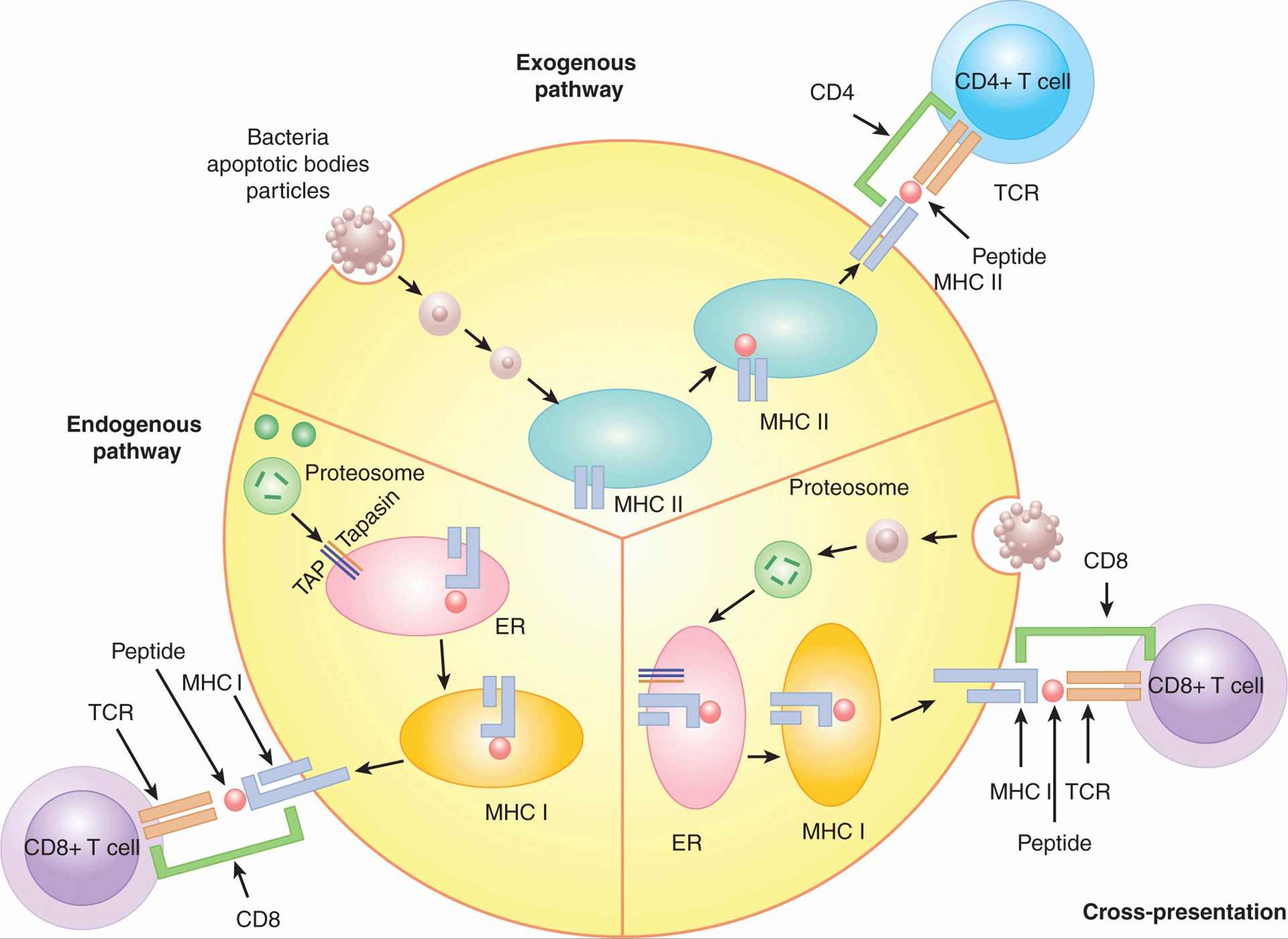
图 21–2 APC 中的抗原加工途径. APC 处理抗原有 3 条途径:外源性、内源性和交叉呈递。
- 外源途径处理在 APC 外产生的蛋白质,并将它们的肽置于 MHC II 类上以供 CD4+ T 细胞识别。来自凋亡小体、细菌和颗粒抗原的蛋白质通过外源途径加工成肽。外源性途径发生在吞噬细胞中,包括 B 细胞、巨噬细胞和树突细胞。
- 内源性途径将细胞产生的肽置于 MHC I 类的肽结合槽中,供 CD8+T 细胞识别。内源性途径负责病毒肽或自身肽的免疫识别。肽被蛋白酶体从胞质溶胶中的蛋白质上切割下来。然后它们在依赖于与抗原加工相关的转运蛋白 (TAP) 的过程中进入内质网 (ER) 并加载到 MHC I 类上,然后穿梭到细胞表面。该途径发生在大多数细胞中,而不仅仅是 APC,允许感知所有细胞类型中的病毒感染。
- 交叉呈递途径还将肽加载到 MHC I 类以供 CD8+T 细胞识别,但加工的蛋白质不是细胞内在的,而是从周围环境中摄取的。该途径对于检测感染 APC 以外的细胞的病毒和以肿瘤凋亡小体形式摄取的肿瘤抗原很重要。交叉呈递途径在树突细胞中最有效。
当 APC 通过吞噬作用或受体介导的内吞作用从细胞外获取物质时,蛋白质加工的外源途径就开始了。这种外源性物质最初在酸化的早期内体中通过 pH 敏感蛋白酶进行加工。含有片段化蛋白质的内体最终与含有新形成的 MHC II 类分子的囊泡融合,然后肽在 MHC 分子的裂缝中结合。 MHC II 类是在内质网中产生的。当蛋白质产生时,称为不变链的伴侣蛋白最初占据肽结合沟。当 MHC/不变复合物离开高尔基体时,不变链靶向复合物进入内体途径,在那里称为组织蛋白酶的蛋白酶消化不变链,直到只有一个称为 CLIP(II 类相关不变链衍生肽)的小片段留在结合裂缝中。 MHC II-CLIP 复合物接下来与有助于释放 CLIP 的蛋白质结合,释放肽结合槽,供外部获得的肽占据。在这种肽交换之后,复合物被穿梭到细胞膜上,在那里它可以被 CD4+ Th 细胞识别(Bryant 和 Ploegh,2004 年;Trombetta 和 Mellman,2005 年)。
内源性途径负责将细胞内在蛋白装载到 MHC I 类分子的结合裂缝中。蛋白质被称为蛋白体的大分子复合物消化(参见第 8 章,图 8-9 和第 9 章,图 9-4)。蛋白质体通常处理自身蛋白质,但当细胞暴露于炎性细胞因子,如干扰素-γ (IFN-γ) 或肿瘤坏死因子 (TNF)-α 时,蛋白质体的结构会改变为称为免疫蛋白质体的结构,这在加工肽时更有效,对 MHC I 类肽结合裂缝具有高结合效率。自身蛋白被细胞质中的蛋白体切割成短片段,然后被TAP蛋白复合物穿梭到内质网中。当肽被 TAP 转运蛋白引导到内质网时,它们被加载到空的 MHC I 类分子上,这些分子通过蛋白质 Tapasin 靠近 TAP 复合物。在病毒感染的情况下,源自病毒的肽将被加工并加载到 MHC I 类分子上,从而导致 CD8+ T 细胞检测到病毒。在肿瘤细胞的情况下,源自肿瘤细胞的蛋白质将被加工并通过交叉呈递途径加载到 MHC I 类(Pamer 和 Cresswell,1998)。
T 细胞的有效激活取决于 APC 对抗原的获取以及随后将选定的肽与 MHC 分子结合呈递到细胞表面以供 T 细胞识别。 由于 MHC I 类限制性肽源自细胞内在产生的蛋白质,因此如何针对感染 APC 以外的细胞类型的病毒或细菌启动 T 细胞反应,存在一个难题。 可以发生称为交叉呈递的过程,其中细胞外源蛋白可以被 DC 吸收并呈递在 MHC I 类分子上(见图 21-2)。 该途径对于激活肿瘤特异性 T 细胞至关重要,因为肿瘤细胞通常不是 APC。 对许多肿瘤的可测量 T 细胞反应的存在意味着在某一时刻,DC 可能已经获得了肿瘤来源的蛋白质并将它们加工成 MHC I 类限制性肽,导致初始肿瘤反应性 CD8+ T 细胞的激活(Shen 和摇滚,2006 年)。
2.2 抗原提呈细胞的成熟
APC 可以以未成熟状态或成熟(即激活)状态存在(图 21-3)。APC 的成熟通过识别病原体相关分子模式 (PAMP) 的特化细胞表面受体或细胞内受体发生。这些受体类别包括 Toll 样受体 (TLR)、核苷酸结合域和富含亮氨酸的重复受体 (NLR)、视黄酸诱导基因样受体 (RLR) 和 c 型凝集素(Iwasaki 和 Medzhitov,2010) . 研究最多的受体是 TLR 蛋白家族(Takeda 和 Akira,2005)。TLR 的配体包括病毒/细菌 DNA 和 RNA、细菌脂质和内源性分子,如热休克蛋白和尿酸晶体,它们会提醒免疫系统注意组织损伤。在哺乳动物中至少有 11 个已鉴定的 TLR,其中 9 个在人和小鼠之间是保守的(TLR1 到 TLR9)。TLR4 是特征最好的 TLR 之一;TLR4 的病原体相关配体是脂多糖 (LPS),这是一种存在于革兰氏阴性菌外膜上的分子。正在研究几种 TLR 刺激物用作人体免疫佐剂。例如,药物咪喹莫特(见 21.3.3 ),用于治疗疣,激活 TLR7。由咪喹莫特等药物或病毒感染通过 TLR7 发出信号,导致产生干扰素α TLR9 识别未甲基化的 CpG(胞嘧啶磷酸鸟嘌呤)DNA 结构(Hemmi 等,2000),这在细菌 DNA 中很丰富,但在哺乳动物中很少见。CpG DNA 激活 TLR9 导致细胞因子白细胞介素 (IL)-12 和 TNFα 的产生,这有助于诱导细胞介导的免疫。
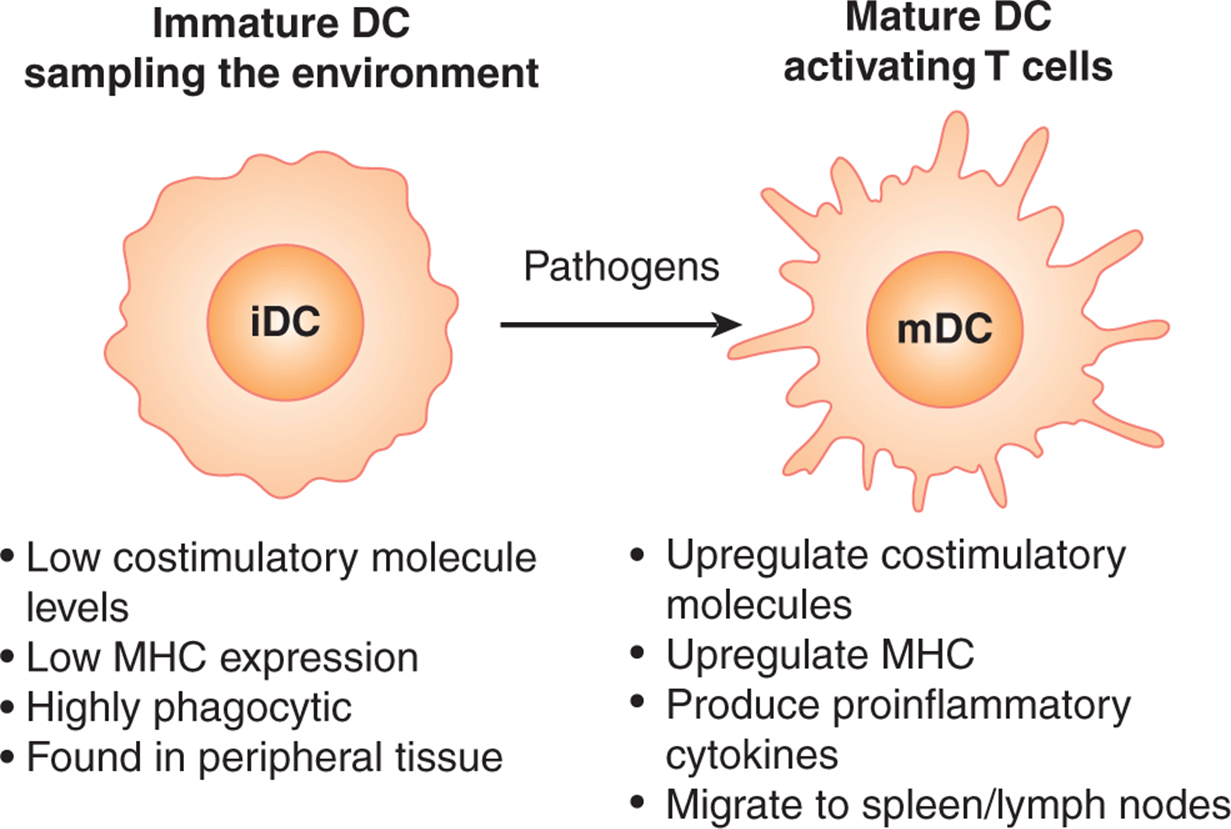
图 21-3 DC 成熟和迁移。 DC 是免疫系统最有效的哨兵,在外周组织中迁移以寻求损伤或感染。未成熟 DC (iDC) 的共刺激分子和 MHC 的表达较低。这限制了在没有感染或组织损伤的情况下 T 细胞的不当激活。iDC 具有很强的吞噬能力,可以从局部环境中采集抗原。一旦遇到成熟信号,例如 Toll 样受体 (TLR) 家族分子的配体或 CD40 分子的连接,iDC 会增加共刺激分子和 MHC 的水平,并迁移到局部引流淋巴结,在那里它可以与激活 T 细胞。 mDC,成熟树突细胞。
NOD 样和 RIG-I 样蛋白家族(NLR 和 RLR)分别检测细菌和病毒的存在。NLR 蛋白通过与 C 末端富含亮氨酸的重复区域 (LRR) 相互作用来感知细胞质中的细菌产物。细菌衍生产物与 LRR 结合,导致细胞内 NOD 蛋白的构象变化。这种变化激活 NOD 蛋白,通过与半胱天冬酶募集结构域 (CARD) 结合,导致信号激酶募集和半胱天冬酶 (CASP)-1 的激活。这种激活通过激活核因子-κB (NF-κB) 和 AP1 转录因子导致从头细胞因子转录(参见 第 8 章, 第 8.2.6 节)) 和通过 CASP-1 活性激活 IL-1 (Franchi et al, 2009)。RLR 也位于细胞质中,但与病毒衍生的 RNA 序列结合。RLR 系列包含多个成员,例如 RIG-I、MDA-5 和 LGP2。这些蛋白质结合在病毒产生的 RNA 的 5' 端发现的修饰,而这些修饰在哺乳动物 RNA 中没有。检测细胞质中的病毒 RNA 会激活 NF-κB 和 IRF3(干扰素调节因子 3),从而诱导感染细胞产生炎性细胞因子和 1 型干扰素(Kawai 和 Akira,2008 年)。
通过这些不同的受体家族检测到病原体后,APC 变得成熟并上调 MHC II 类和其他有助于 T 细胞活化的共刺激分子的表达(见图 21-3)。此外,成熟的 APC 被诱导分泌细胞因子和趋化因子,以多种方式促进免疫功能。通过 TLR 的信号传递也会引起 APC 迁移的变化。DC 将改变它们对趋化因子信号的反应,并迁移出外周组织并定位(“归巢”)到淋巴结,从而增加它们遇到对激活 DC 的病原体具有特异性的 T 细胞的机会。单核细胞和巨噬细胞将以相反的模式迁移,进入受感染或受损的组织,参与病原体清除或组织修复,同时充当局部 APC 以维持感染部位 T 细胞的活化。
三、自适应免疫
3.1 淋巴细胞多样性的产生
B 细胞和 T 细胞表达高度特异性的识别抗原的受体。作为基因组 DNA 重排的结果,B 细胞受体 (BCR) 和 T 细胞受体 (TCR) 在每个细胞中独特地产生。 BCR 是可溶性免疫球蛋白(抗体)的膜结合形式,由于结合特定抗原的能力,该细胞在激活后会产生这种免疫球蛋白。BCR 可以以其天然形式与抗原结合,因此 B 细胞可以检测未加工的抗原。相比之下,TCR 不分泌,通过 TCR 刺激可能导致 T 细胞反应的激活。T细胞对抗原的识别也不同于B细胞对抗原的识别。T 细胞不与未加工形式的抗原反应,而是识别结合在 APC 的 MHC 中的肽片段(如上所述;另见 图 21-1 )。这些差异允许 B 和 T 细胞以两种不同的方式保护宿主:直接识别病原体和识别被病原体感染的细胞。
该TCR由2条蛋白链通过二硫键(接合在一起图21-4甲)。该二聚体可以由 α 和 β 链或 γ 和 δ 链组成。αβ TCR 存在于血液和淋巴器官中发现的大多数成熟 T 细胞上,而携带 γδ TCR 的 T 细胞主要存在于皮肤和肠道中。TCR 在细胞表面以一种分子复合物表达,该复合物包括具有细胞内信号结构域的蛋白质(免疫受体酪氨酸激活基序;ITAM):CD3δε、CD3γε 和 TCRζζ 一旦 TCR 与特定的肽/MHC 复合物结合,ITAM 在CD3 和 TCR 分子聚集在一起并启动细胞内信号级联反应。
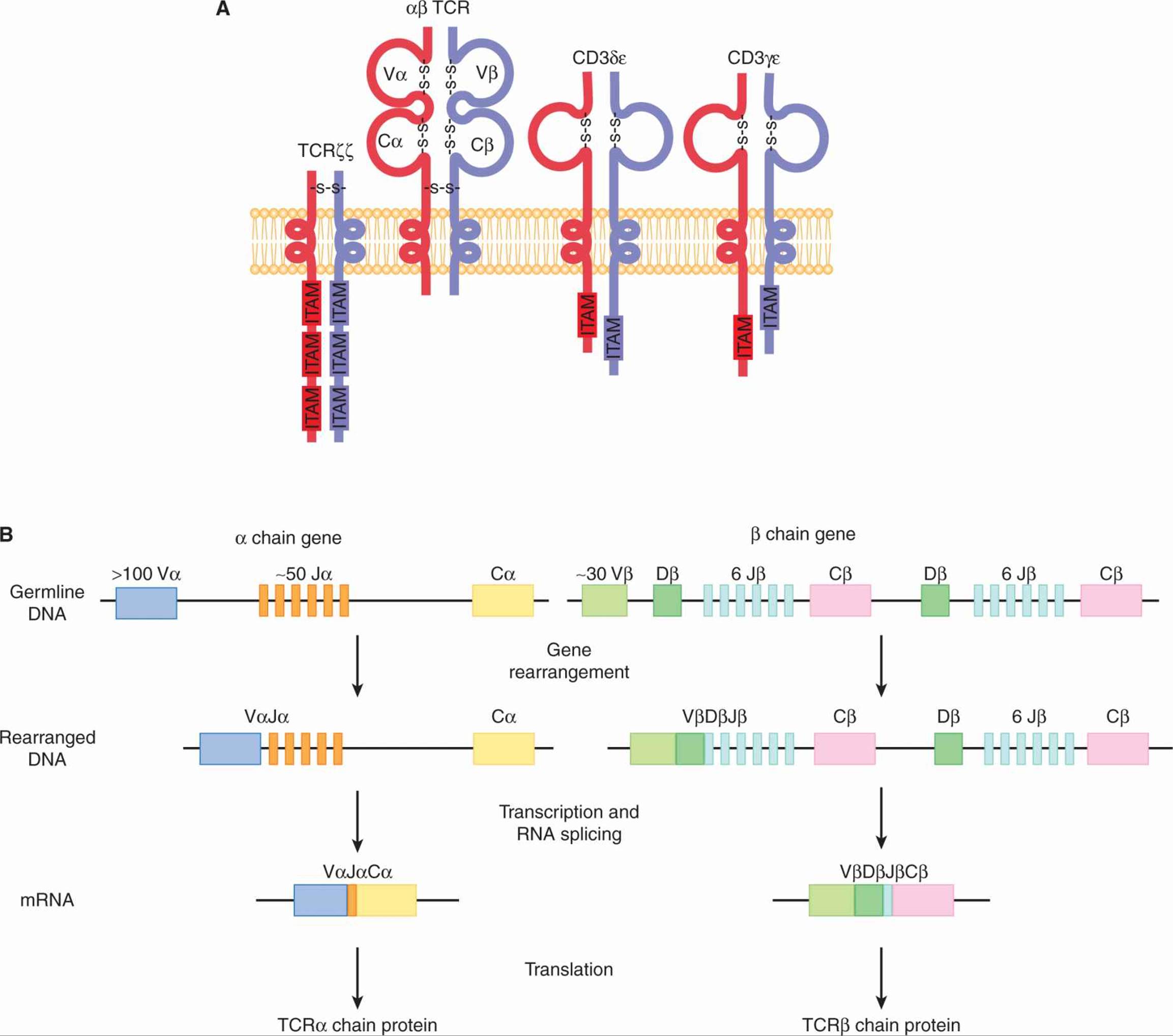
图 21-4 TCR。A) TCR 由 2 条链组成,α 和 β,每条链包含 2 个由链内二硫键形成的免疫球蛋白结构域。TCR 与二聚体蛋白 CD3δε、CD3γε 和 TCRζζ 相关,并与 αβ TCR 一起构成 TCR 复合物。 ITAM,基于免疫受体酪氨酸的激活基序。 B) TCR 的变量 (V)、多样性 (D)、连接 (J) 和恒定 (C) 域由相应的基因片段编码,这些基因片段经过体细胞重排以生成 αβTCR 异二聚体。在小鼠中, α 链由 100 多个 V、大约 50 个 J 和 1 个 C 基因片段组成。该 β 链由大约 30 个 V 区和 2 个簇组成,每个簇有 1 个 D、6 个 J 和 1 个 C 基因片段。在 V(D)J 基因重排和转录之后,RNA 被剪接到 C 基因片段。由此产生的信使 RNA (mRNA) 编码 TCR 链,这些链可以二聚化形成完整的 TCR 蛋白。
TCR 链不是作为单个转录本编码的;相反,它们是基因组 DNA 重排的结果,将不同的基因片段聚集在一起并将它们拼接成一个组合外显子(戴维斯,1990;见图 21-4 B)。这种基因组剪接依赖于一种称为重组激活基因重组酶 ( RAG 重组酶),仅在发育中的 T 和 B 细胞中表达(Krangel,2009)。TCRα 链由 2 个独立的重排基因片段组成,在重组过程中聚集在一起。可变 (V) 基因片段通过连接 (J) 基因片段进行重排,并与恒定 (C) 区一起表达,形成 TCR 的 α 链。β 链有 3 个重排的基因片段:可变区、多样性区 (D) 和连接区,这些区经过重排并与 β 基因座的恒定区一起表达。α 链中的 VJ 和 β 链中的 VDJ 的大量可能组合导致 T 细胞群之间的巨大差异,特别是当每个成熟的 T 细胞将独立地重新排列自己的 TCR 时(Krangel,2009;见图 21– 4乙)。此外,一种称为“N 区多样性”的策略会在重排过程中产生额外的核苷酸,从而增加每个 TCR 可以识别的抗原库。TCR 对结合在 MHC 分子凹槽中的特定肽的特异性由称为互补决定区 (CDR) 的 TCR 区域决定。CDR 与肽/MHC 复合物的相互作用是表达的 V 链组合的结果,也是 VJ 和 VDJ 基因片段配对产生的多样性的结果。
3.2 T 细胞活化
成熟 T 细胞的功能状态取决于它是否表达可以与成熟 APC 表达的肽/MHC 分子结合的受体。T 细胞可以以幼稚 或静止状态存在 ,也可以是 效应 T 细胞,这意味着它们已经与带有同源抗原的成熟 DC 细胞结合,并随后分化为功能性 T 细胞。或者,它们可以是 记忆 T 细胞,它们是先前被激活的抗原特异性细胞,在病原体被消除后仍然存在。这 3 种状态(幼稚、效应和记忆)赋予完全不同的表型和功能特性(图 21-5)。这些发育阶段在 CD8+ MHC I 类限制性 T 细胞谱系中得到了最广泛的研究,因此以下大部分信息将涉及 CD8+ T 细胞;然而,它们也广泛适用于 CD4+ T 细胞。
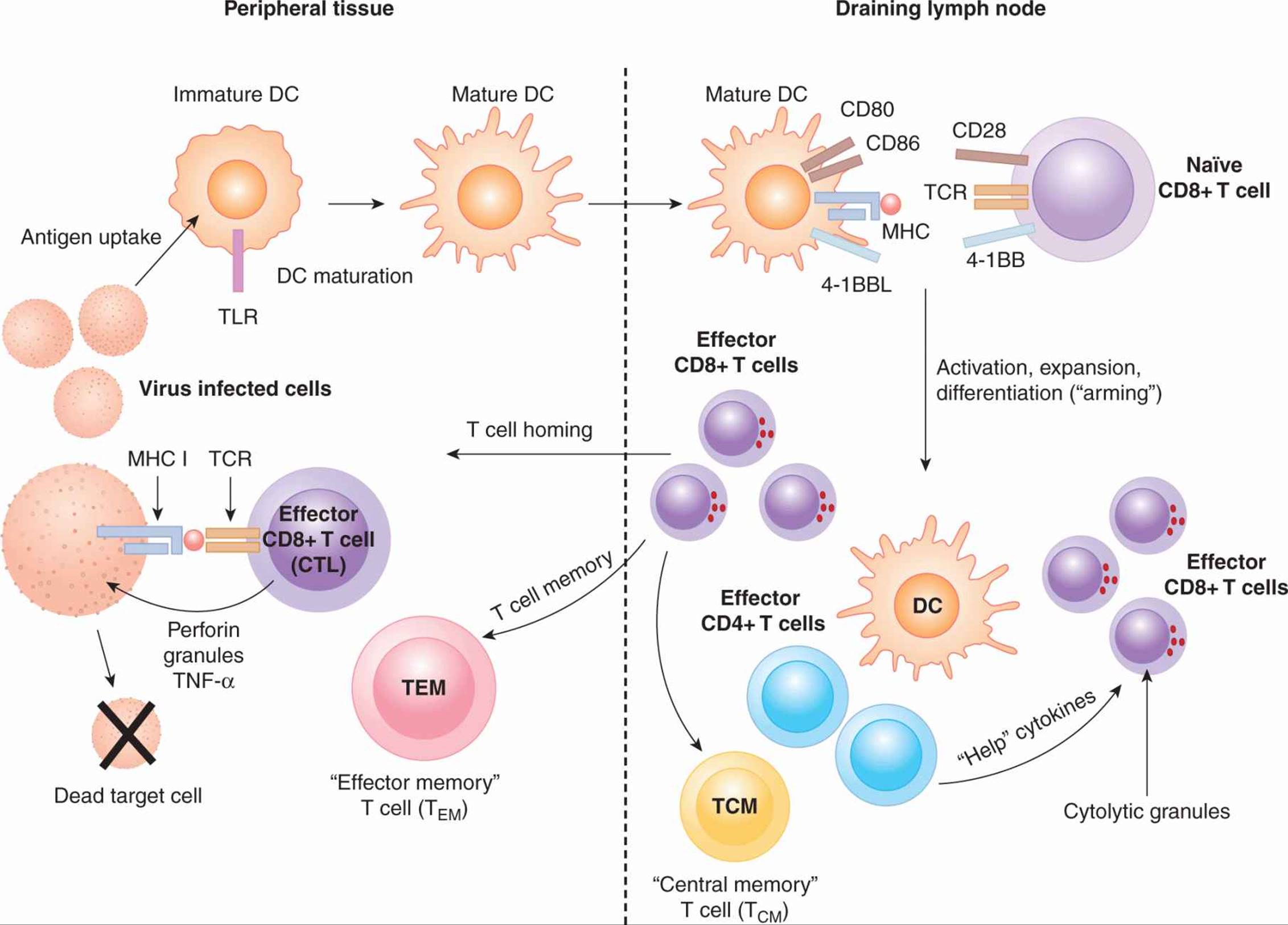
图 21-5 细胞毒性 T 细胞反应的阶段。 当 DC 被外周的病原体或炎症信号激活时,CD8+ T 细胞免疫反应开始。抗原被 DC 拾取并加工成肽,并通过交叉呈递途径置于 MHC I 类分子上。成熟的 DC 迁移到淋巴结中的 T 细胞区域,在那里它们与原始 T 细胞相互作用。T 细胞识别其与 DC 上 MHC I 类结合的同源肽,从而激活 T 细胞。如果 TCR 信号之后是 T 细胞上的 CD28 与 DC 上的 CD80 和 CD86 相互作用的共刺激,T 细胞将开始增殖,扩大对抗原具有特异性的 T 细胞的克隆。CD8+ T 细胞将通过暴露于导致细胞溶解颗粒形成的细胞因子而武装起来。
大多数 T 细胞反应可以细分为 3 个阶段:激活(也称为启动)、扩张和收缩(图 21-6)。幼稚 T 细胞的激活阈值很高,这意味着当成熟 T 细胞第一次遇到其同源抗原/MHC 复合物时,它的反应很慢,需要几个信号来启动增殖和获得效应器功能。DC 是负责 T 细胞活化的主要细胞。在启动过程中,DC 获得抗原并在感染部位成熟,然后到达引流淋巴结,在那里它进入 T 细胞区域并与驻留在那里的 T 细胞相互作用。“整合素”受体-配体相互作用发生在 T 细胞上的白细胞功能相关抗原 (LFA)-1 和 LFA-2 与 DC 上表达的细胞间粘附分子 (ICAM) 之间。这些相互作用最初会减缓 DC 通过幼稚 T 细胞的迁移,然后帮助使 2 个细胞膜靠近, 图 21-6)。如果成熟的 DC 在其 MHC 分子上呈递一种肽,该肽被 T 细胞上的特定 TCR 识别,则信号将被发送到 T 细胞中。这种抗原特异性识别,连同其他受体配体相互作用,促进功能性 T 细胞反应。导致最佳 T 细胞活化的经过充分研究的分子之一是 CD28。CD28 的配体是 CD80 (B7-1) 和 CD86 (B7-2),它们在成熟 DC 的表面上调。这种 CD28 共刺激信号导致 IL-2 的产生,IL-2 是一种对 T 细胞增殖和存活至关重要的细胞因子(图 21-6)。T 细胞活化还会导致其他几种分子的表达增加,包括 CD154,它是存在于 DC 表面的 TNF 家族成员 CD40 的配体。CD40 与 DC 的结合导致共刺激分子、细胞因子的上调和 DC 存活率的增加,从而延长抗原呈递时间(Quezada 等,2004)。T 细胞和 DC 之间的正反馈回路导致抗原特异性 T 细胞克隆的扩增。这些扩增的 T 细胞现在是功能性效应 T 细胞,可改变其趋化因子和整合素的表达模式;它们离开淋巴结和发炎部位。
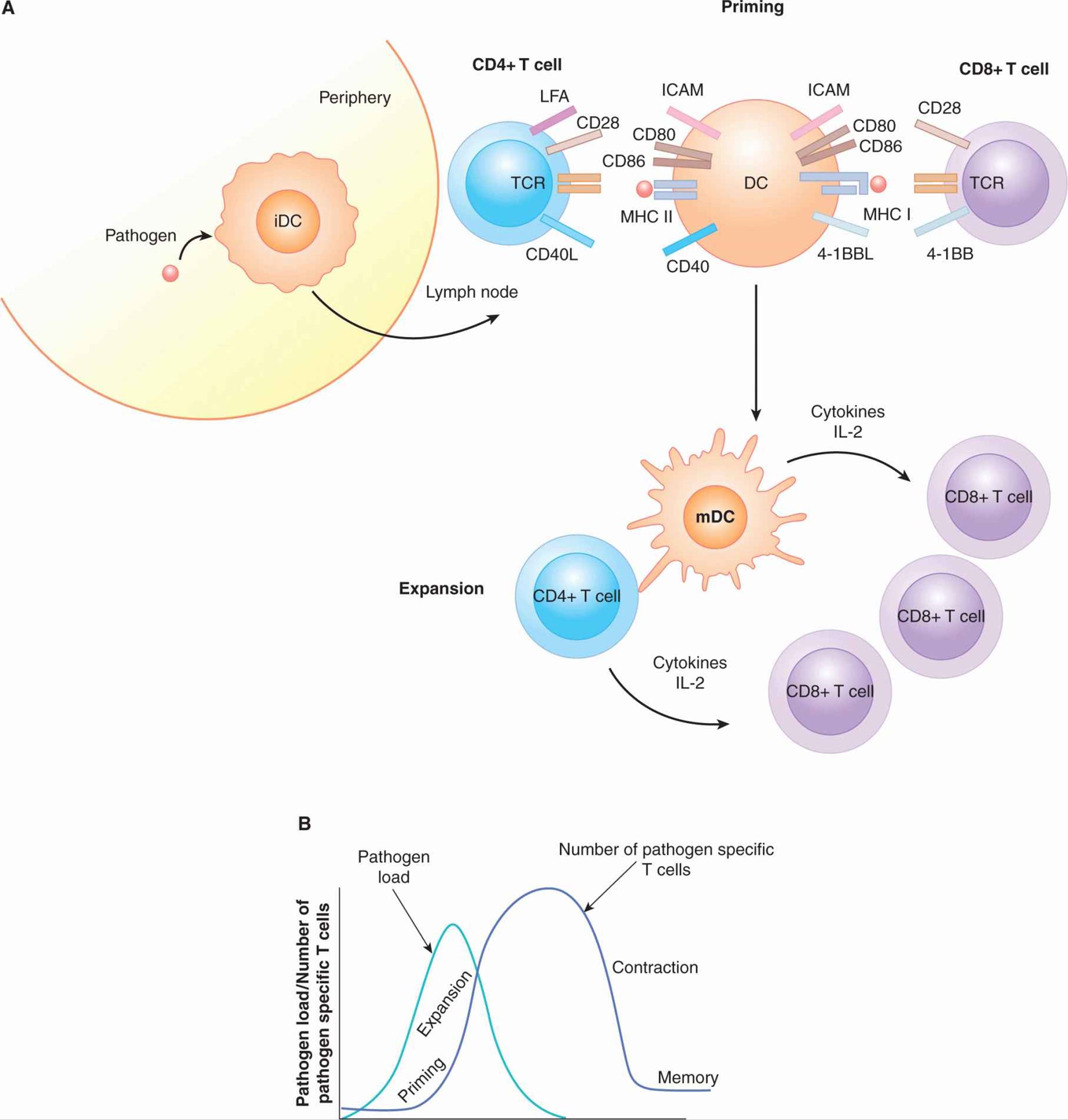
图 21–6 T 细胞活化:启动、扩张和收缩。A) 在感知外周组织中的组织损伤或感染后,带有 DC 的抗原迁移到引流淋巴结的 T 细胞区域。DC 和 T 细胞在淋巴结中混合,通过 T 细胞上的 LFA(淋巴细胞功能相关抗原)和 DC 上的 ICAM(细胞间粘附分子)之间的相互作用相互粘附。具有对感染部位获得的抗原具有特异性的 TCR 的 AT 细胞将与 DC 相互作用并通过抗原特异性 TCR 发出信号。同时,T 细胞上的 CD28 会与 DC 上的 CD80 和 CD86 结合。这个信号被称为 共刺激. CD4+ T 细胞将表达 CD40 配体 (CD154),该配体与 DC 上的 CD40 结合,促进带有抗原的 DC 的存活并增加细胞因子的产生。接受这些信号的抗原特异性 CD8+ 和 CD4+ T 细胞将开始分裂。这些扩增的抗原特异性 T 细胞然后移动到外周组织以清除感染。 乙) T细胞免疫反应可以分为几个阶段。当抗原首次呈递给幼稚 T 细胞并首次被诱导扩增时,就会发生引发。随着免疫系统清除抗原水平下降,抗原特异性 T 细胞克隆发生收缩。收缩后,与感染前相比,保留了更多数量的特定 T 细胞。这些细胞被称为记忆 T 细胞,并且具有使它们能够对同一病原体的再感染快速反应的特性。
3.3 T 细胞记忆
在引发 T 细胞反应的病原体被清除后,对该病原体作出反应的效应 T 细胞消失,只留下一小部分特化 T 细胞,称为 记忆 T 细胞。这些细胞在再次遇到合适的抗原时会迅速做出反应,从而提供保护,防止随后受到相同病原体的感染。记忆 T 细胞是 CD8+,可细分为 2 类:效应记忆 T 细胞 (T EM ) 和中央记忆 T (T CM ) 细胞。这些子集可以通过它们的定位、表面分子表达和功能来定义。TCM 细胞存在于次级淋巴组织中。这些细胞表达趋化因子受体 CCR7,表达高水平的 CD62L,并且没有预先形成的裂解颗粒。T CM 细胞很可能代表一组抗原特异性 CD8+ T 细胞,它们准备在第二次遇到其同源抗原时再次扩增。T EM 细胞存在于非淋巴组织中:这些细胞已经形成溶细胞颗粒,并准备在病原体进入部位立即发挥作用。T EM 细胞是根据 CD8+、CD62 低和 CCR7– 的特征来识别的。记忆 CD8+ T 细胞的维持部分依赖于 2 种细胞因子,IL-7 和 IL-15(Kalia 等,2006)
3.4 T 细胞亚群
如果 TCR 对靶细胞表达的 MHC I 类分子呈递的肽具有特异性,则 CTL 是具有直接杀死靶细胞能力的 CD8+ T 细胞。CD8+ T 细胞从静止的幼稚 T 细胞分化为成熟的 CTL 包括形成溶细胞颗粒(见图 21-5)。溶细胞颗粒包含分子穿孔素和颗粒酶家族的蛋白酶。TCR 与 CTL 结合后,溶细胞颗粒与细胞膜迅速融合,释放穿孔素和颗粒酶。穿孔素在靶细胞膜上形成孔,允许颗粒酶蛋白酶进入。颗粒酶启动靶细胞内蛋白质的裂解,结果是细胞凋亡。
Th 细胞表达 CD4 共受体并识别 MHC II 类分子呈递的肽。Th细胞可以分为几个亚组,这些亚组由它们的功能特性和/或它们产生确定的细胞因子谱的能力来定义(图21-7)。第一个确定的 Th 细胞亚群被称为 Th1 和 Th2 并代表了 CD4+ 成熟 T 细胞分化的 2 个离散途径。Th1 细胞表达转录因子 T-BET(Szabo 等,2000);它们产生高水平的细胞因子 IL-2、TNF-α 和 IFN-γ,并诱导 APC 产生 IL-12。Th1 细胞主要增强 CD8+ CTL 型反应,重点是消除细胞内病原体,如病毒和细胞内细菌。Th2 细胞介导体液(抗体)反应,通常针对细胞外病原体和寄生虫。Th2 T 细胞产生 IL-4 以及其他细胞因子:IL-4 与其 CD4+ T 细胞上的受体结合导致信号转导和转录激活因子 6 (STAT6) 激活和 GATA3 转录,GATA3 是主要转录因子(参见 第 8 章, 第 8.3.1 节) Th2 细胞功能所需 (Zheng 和 Flavell,1997)。
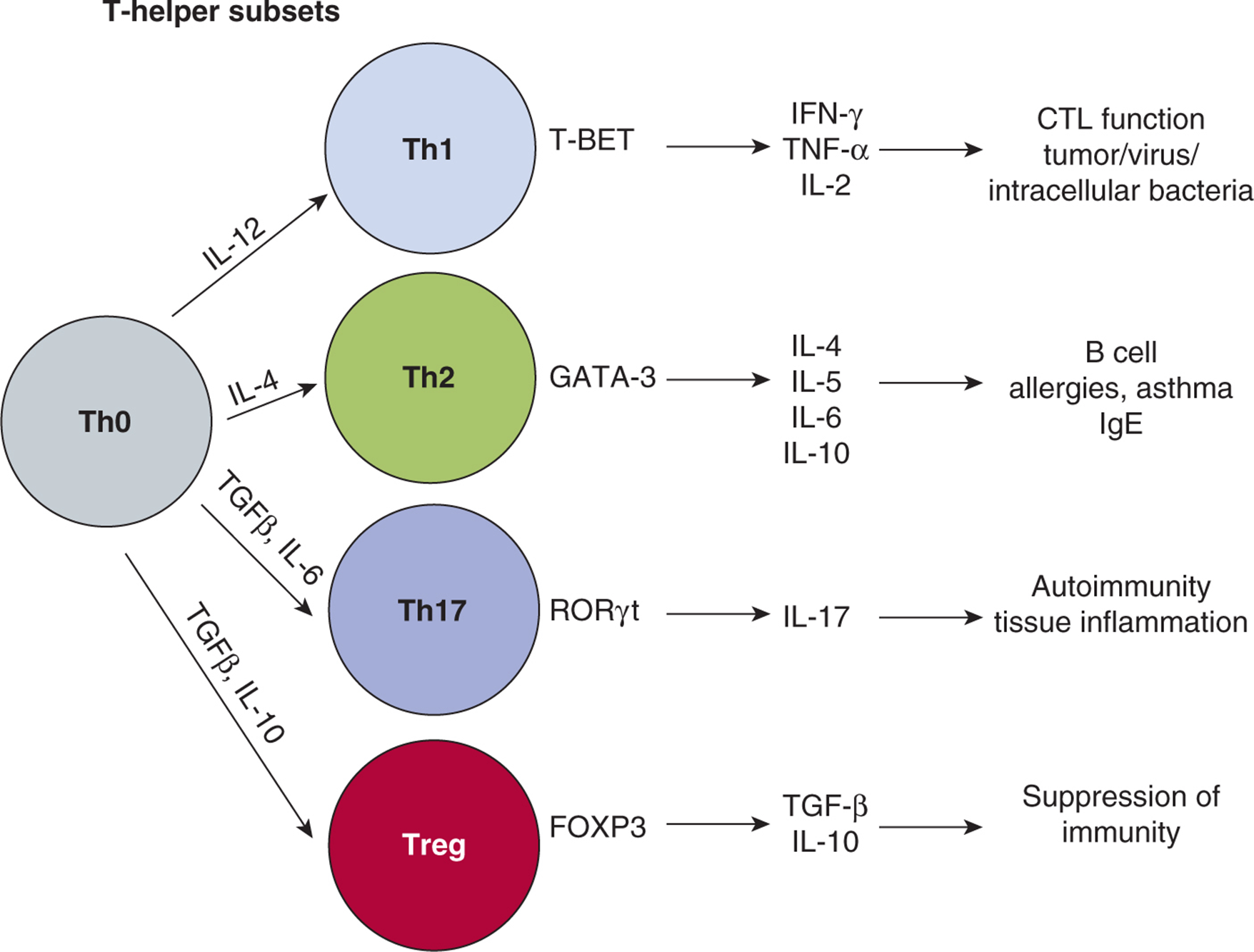
图 21-7 Th 细胞亚群。 Th细胞表达CD4辅助受体并识别APC的MHC II类分子上呈递的肽。通过 TCR 激活后,T 细胞沿着 4 条分化途径中的 1 条下降,导致不同的效应子功能。当幼稚的 CD4+ T 细胞 (Th0) 在不同细胞因子和信号条件存在的情况下被激活时,这些途径就开始了。已经确定分化途径依赖于由特定转录因子强制执行的转录模式。分化后,亚群产生表征其最终效应子功能的细胞因子的特征集。
一个新发现的 Th 子集被命名为 Th17,因为它能够产生细胞因子 IL-17,据信其作用于局部组织以促进炎症(McGeachy 和 Cua,2008 年)。许多类型的自身免疫性疾病都需要这些细胞(Gutcher 和 Becher,2007 年),它们在抗肿瘤反应中的可能作用引起了人们极大的兴趣(Ji 和 Zhang,2010 年)。
调节性 T 细胞 (Treg) 代表另一种具有抑制免疫反应能力的 CD4+ T 细胞群。该子集是预防自身免疫性疾病的关键。在小鼠中,它们已被证明表达标记 CD25 和 FoxP3,它们的存在取决于转录因子 FoxP3。Tregs 有 2 个主要来源。在胸腺选择过程中会产生一个子集,称为天然 T reg (nTreg)。第二组 Tregs 来源于成熟的外周 CD4+ T 细胞,通过其环境中的信号转化为调节细胞;它们被称为诱导性 Tregs (iTregs)(Jonuleit 和 Schmitt,2003;Josefowicz 和 Rudensky,2009;Sakaguchi 等,2008)。
3.5 抑制 T 细胞活化
需要激活 T 细胞来解决许多感染,但不受控制的 T 细胞激活可能会导致对周围组织的损害。共刺激激活剂和抑制分子之间的平衡能够在适当的时候抑制 T 细胞反应。其中两种抑制分子是细胞毒性 T 淋巴细胞抗原 (CTLA)-4 和程序性死亡 (PD)-1。
-
CTLA-4 在 TCR 与 T 细胞结合后上调,尽管它在 Tregs 上组成性地被发现。CTLA-4 与 CD28 竞争结合 CD80 和 CD86。研究表明,CTLA-4 对 CD80 和 CD86 的亲和力高于 CD28。APC 表面 CD80/86 的簇向 APC 发送信号以激活称为吲哚胺 2,3-脱氧酶 (IDO) 的酶,IDO 反过来代谢色氨酸并抑制 T 细胞增殖。通过 CTLA-4 信号进入 T 细胞会募集含有 Src 同源域的磷酸酶 (SHP)-1 并中断 TCR 信号。CTLA-4 在抑制 T 细胞反应中的关键作用在经过基因操作而缺乏 CTLA-4 蛋白的小鼠(CTLA-4“基因敲除”小鼠)中很明显,因为这些小鼠会产生严重的自身免疫(Fife 和 Bluestone, 2008)。
-
PD-1 与 CTLA-4 一样,在活化的 CD4+ 和 CD8+ T 细胞上表达,但始终存在于 Treg 上。有 2 种已知的 PD-1 配体。PD-L1 (B7-H1) 表现出广泛的表达;它存在于许多非造血细胞以及免疫细胞(包括 APC)上。PD-L2 的表达主要限于 APC。已在许多肿瘤中发现 PD-L1 的表达,并且与不良预后相关。通过 PD-1 发出信号会阻断效应 T 细胞的功能和存活。已显示 Treg 表达 PD-1 和 PD-L1(Fife 和 Bluestone,2008)。
3.6 T 细胞耐受性
由于 TCR 的重排是随机的,因此不可避免地会出现对自身抗原特异的组合。胸腺的主要作用之一是产生功能性而非自身反应性 T 细胞。这个过程可以分为两个主要事件(Sebzda 等,1999)。首先,T 细胞必须表达能够与自身 MHC 分子相互作用的 TCR。这个过程称为 正选择 并且对于仅选择那些表达识别自身 MHC 的受体的 T 细胞很重要,因为所有外源肽都由自身 MHC 呈递。作为正选择的结果,选择库中的每个 T 细胞以识别给定宿主中的不同 MHC 分子;选择是基于 TCR 和 MHC 呈递自身肽之间的弱相互作用。基本上不能与自身 MHC 结合的细胞不会通过它们的 TCR 接收任何信号并经历细胞凋亡(“无选择”)。相反,具有对 MHC 呈递的自身肽具有高亲和力的 TCR 的 T 细胞被删除;这个过程被称为“负选择”。或者,一些高亲和力、自我反应的胸腺细胞通过称为无反应性的过程变得耐受 ,导致 T 细胞失活。最后,对自身肽具有高亲和力的 T 细胞也可能分化为 Treg,其在维持外周耐受中起关键作用(Sakaguchi 等,2003)。胸腺细胞选择模型的示意图如图 21-8所示 。
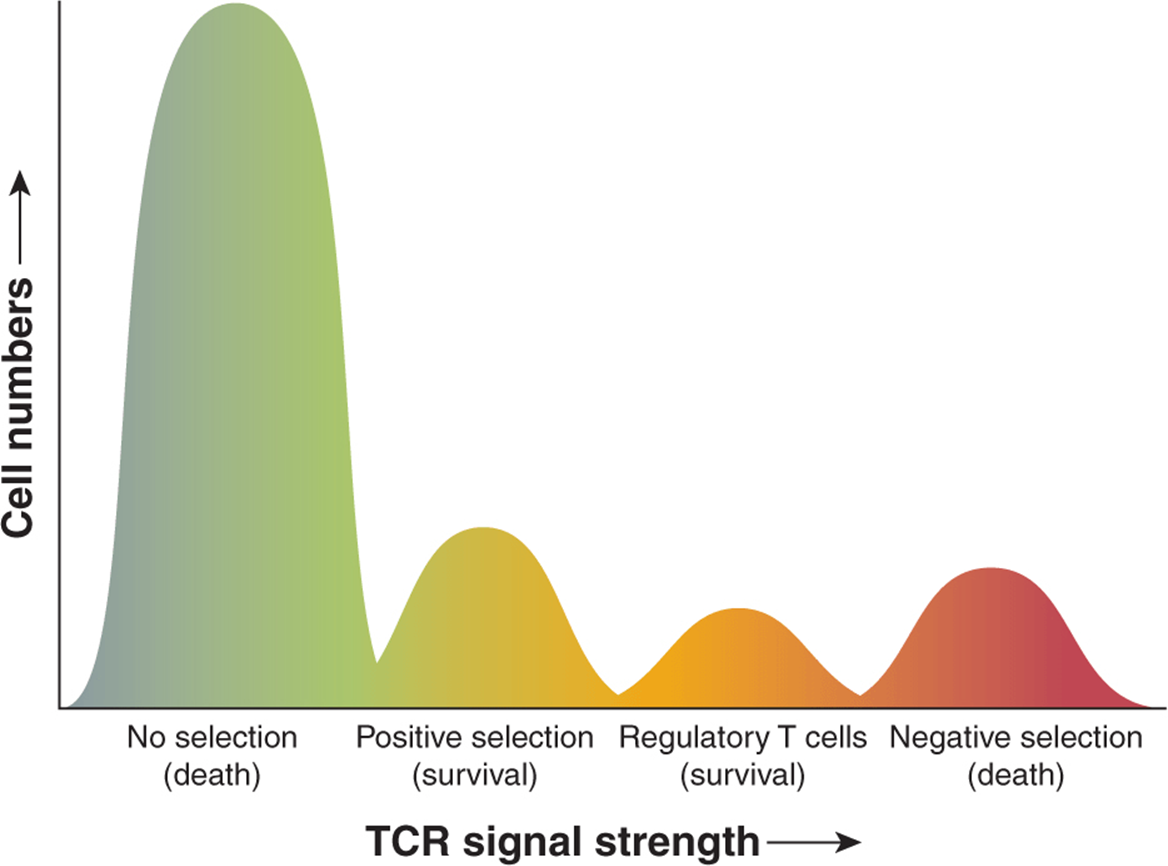
图 21-8 T 细胞选择的阈值。 在胸腺发育过程中选择 T 细胞,因为它们能够在自身 MHC 分子的背景下结合肽,但同时不会被自身肽激活成为效应细胞。TCR 基因的随机基因组重排导致受体对 MHC 结合的自身肽具有不同的亲和力。基本上不能与自身 MHC 结合的 T 细胞不会通过它们的 TCR 接收任何信号并发生凋亡(“无选择”)。与自身 MHC 结合但对自身肽没有强烈反应的细胞完成发育并作为初始 T 细胞进入外周(“阳性选择”)。对自身肽具有中等亲和力的 T 细胞将分化为调节性 T 细胞 (Treg)。最后,产生高亲和力 TCR 的 T 细胞会导致对“自我”的强亲和力,被删除(“负选择”)。
一些自身反应性 T 细胞逃避胸腺中的负选择并进入外周。当某些自身抗原未在胸腺中表达时,该过程很可能发生,因此潜在的自身反应性 T 细胞无法耐受。阻止这些具有自身特异性的 T 细胞被激活的机制可能是 T 细胞固有的,也可能是其他细胞免疫调节的结果。
外周耐受的内在机制包括 缺失 和 无反应性,这类似于发生在胸腺中的自我耐受机制。DCs 有能力在成熟的自反应性 T 细胞缺失或无反应性的“命运”上留下印记。DCs 可以展示从组织中获得的自身抗原,如果 DC 处于静止状态,它会使 T 细胞耐受这些自身抗原。但是,如第 21.2.2 节所述 , DCs 还具有激活免疫系统的能力。允许诱导 T 细胞耐受或 T 细胞免疫的区别是 DC 的“功能状态”:静止或稳态 DC 呈现可导致耐受诱导的肽/MHC 复合物,而成熟或激活的 DC 诱导免疫(Steinman 等,2003)。
诱导耐受性需要一定的自身抗原/MHC 复合物的阈值或浓度(Ohashi,1994)。如果组织特异性抗原未以免疫学可检测水平呈递,则结果是 T 细胞ignorance。在这种情况下,自身反应性 T 细胞以幼稚或无知的状态存在于 T 细胞库中。然而,如果这些细胞在免疫刺激环境中遇到抗原,这些细胞就会被激活以破坏自身组织。这种情况已经在许多模型中得到了实验证明,包括多发性硬化症的小鼠模型,其中髓鞘片段被注射了强大的免疫刺激剂(完全弗氏佐剂 [CFA,complete Freund adjuvant])。在 CFA 诱导的局部炎症背景下,这些髓鞘抗原被呈递给幼稚的自反应 T 细胞。
Tregs 对于维持小鼠和人类的外周免疫耐受至关重要。由于foxp3突变,小鼠缺乏 Treg 表达 基因(Tregs 所需的转录因子),死于严重的多器官自身免疫病。在人类中,损害 Treg 发育或功能的突变与致命的自身免疫性疾病免疫失调、多内分泌疾病、肠病、X 连锁相关(IPEX;Wildin 和 Freitas,2005)。目前的模型提出 Tregs 是抗原特异性的,但以非特异性方式抑制。这种双重性意味着要正常发挥作用,它们需要遇到自身抗原,然后抑制其区域内具有各种抗原特异性的其他 T 细胞的功能。这种现象被称为“旁观者抑制”。Tregs 以多种方式发挥作用,包括细胞接触和可溶性因子介导的机制。活化的 Tregs 具有通过产生颗粒酶 B 直接杀死其局部环境中的 T 细胞和 APC 的能力,颗粒酶 B 可以进入周围细胞并诱导细胞凋亡(Gondek 等,2005)。这种有针对性的消除可以减少炎症部位激活 T 细胞的数量并终止抗原呈递。Treg 也已被证明通过削弱颗粒胞吐作用来抑制 CTL 的杀伤作用(Mempel 等,2006)。存在于 Treg 上的高水平 CTLA-4 将与 APC 上的 CD80 和 CD86 结合,导致色氨酸代谢酶 IDO 的细胞内水平增加(Orabona 等,2004)。这些高 IDO 水平会导致局部环境中色氨酸的消耗,从而抑制 T 细胞增殖(Munn 和 Mellor,2007)。Treg 还表达高水平的 IL-2 受体 CD25,因此,Tregs 结合 IL-2 比局部区域的其他 T 细胞更快。因此,Tregs 可能部分通过限制附近效应细胞可用的这种 T 细胞生长因子的量来发挥作用。活化的 Treg 也被证明可以分泌抗炎细胞因子 IL-10 和转化生长因子 (TGF)-β(Sakaguchi 等,2009);TGF-β 还具有抗增殖功能,可能有助于限制免疫反应。
四、肿瘤免疫学
如上所述,免疫系统具备识别和消除外来威胁的能力,例如细菌和病毒。然而,研究清楚地表明,免疫系统也能够识别肿瘤并针对我们自己的“自身”组织发起免疫反应。在过去的几十年中,已经设计了许多激活或增强对肿瘤的免疫反应的策略作为癌症的治疗方法。
4.1 肿瘤相关抗原
对推动肿瘤免疫治疗领域向前发展至关重要的一个基本方面是肿瘤相关抗原 (TAA) 的鉴定。TAA是肿瘤细胞优先表达的细胞内或细胞外蛋白质,但通常也可由正常细胞表达。如上所述,这些蛋白质以与非肿瘤来源的蛋白质(例如,自身蛋白质或病毒或细菌蛋白质)相似的方式被加工并呈递在MHC I类和II类分子上。因此,特定的 T 细胞可以通过它们的 TCR 识别 TAA。TAA 的鉴定对于肿瘤免疫学和免疫治疗很重要,因为它允许检测和表征可以识别特定 TAA 的 T 细胞。它还允许设计特异性激活 TAA 特异性 T 细胞的免疫疗法,
4.1.1 肿瘤相关抗原 的鉴定
Boon 及其同事鉴定了第一个 TAA(van der Bruggen 等,1991)。使用从转移性黑色素瘤患者身上分离的一组 CTL 克隆,结合来自同一患者的黑色素瘤肿瘤细胞的各种亚系,作者确定了一个基因,其产物被特定的 CTL 克隆靶向。该基因在正常组织中不表达。此外,来自原始患者的 T 细胞可以识别由其他人类白细胞抗原 (HLA)-A 匹配的患者建立的黑色素瘤细胞系,这些患者也表达相同的 TAA。通过这种方法,鉴定了 TAA 的 MAGE、BAGE 和 GAGE 家族。
其他方法已成功识别出许多 TAA。一种方法被称为SEREX(serological analysis of recombinant cDNA expression libraries; Sahin et al, 1995)。从癌症患者身上采集的血清样本被假定含有识别 TAA 的抗体。由从自体肿瘤细胞中分离的互补 DNA (cDNA) 组成的表达文库被克隆到原核表达载体中。这些文库被用于结合抗体,并且被抗体结合的克隆被分离和测序。然后根据 DNA 序列鉴定抗体识别的 TAA。以多种方式确认鉴定的蛋白质为 TAA,包括评估正常和恶性组织中的蛋白质表达。因此,使用 SEREX 方法确定了重要的 TAA,例如 NY-ESO-1。 肿瘤细胞与正常细胞的比较。这些方法 如图 21-9 所示。
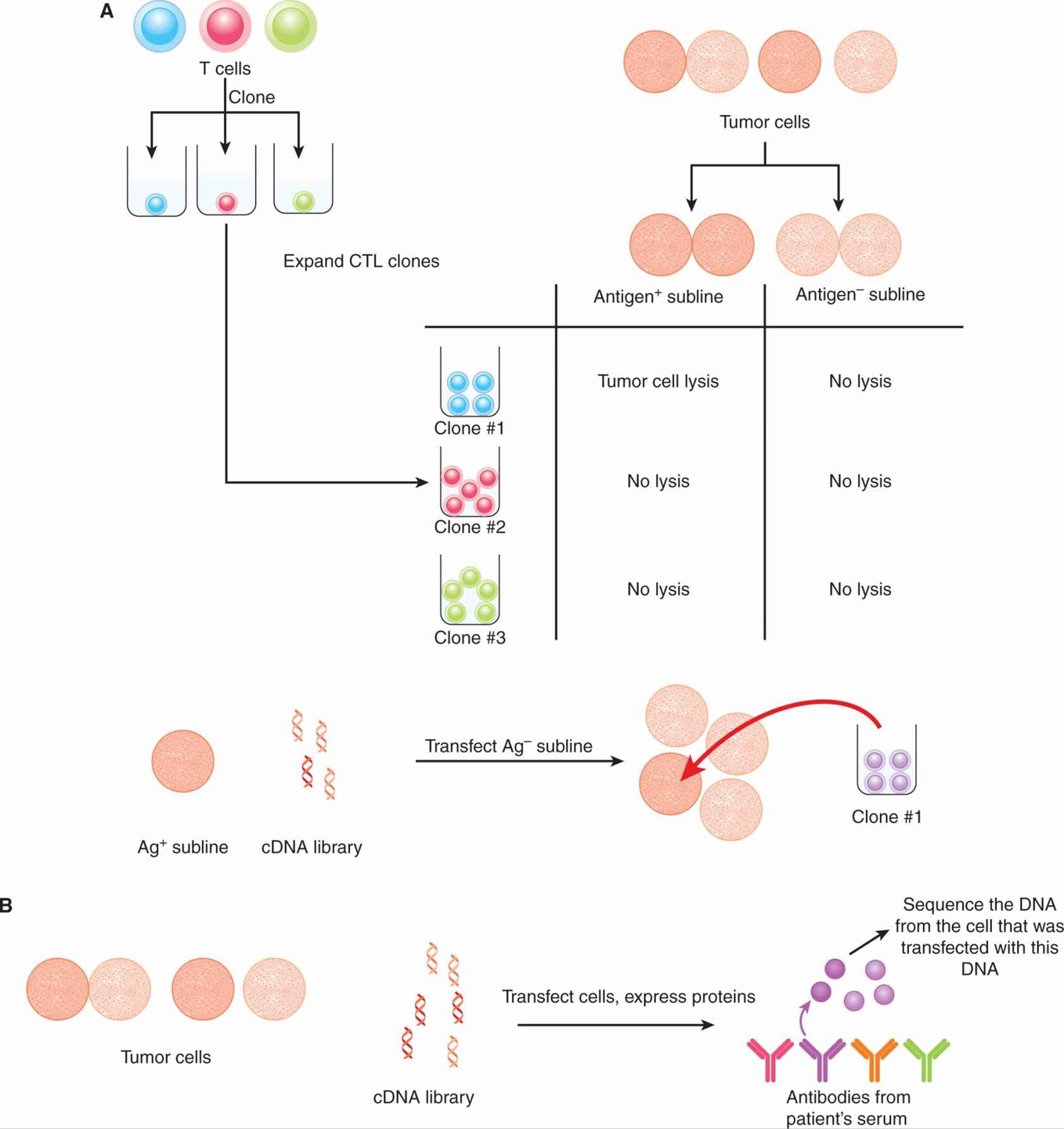
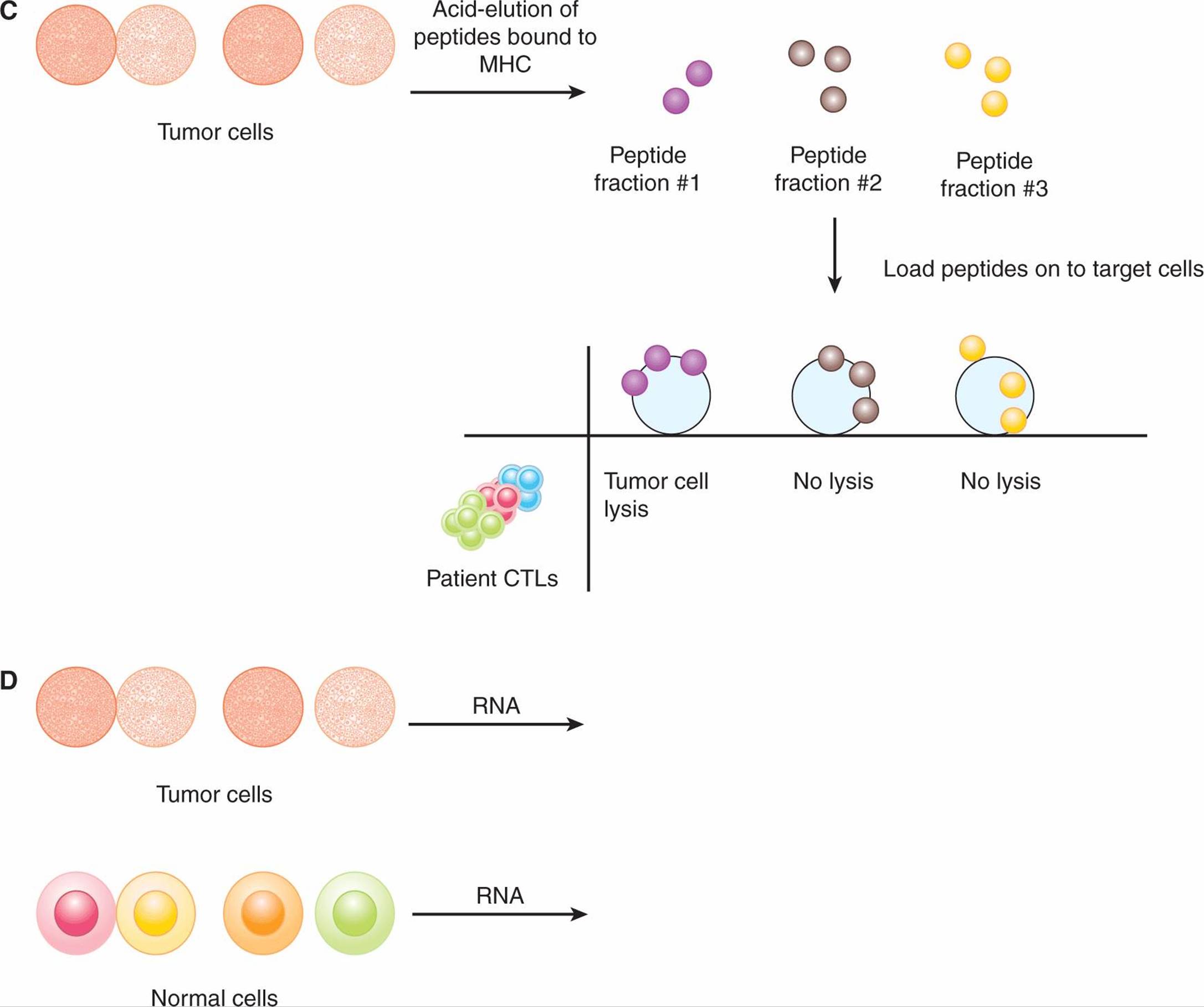
图 21-9 识别 TAA 的方法。A) 来自癌症患者的 CTL 通过以每孔 1 个细胞接种并扩展每个克隆来克隆。自体肿瘤细胞在体外培养并获得各种亚系,其中一些是“抗原丢失”变体。测试 CTL 克隆溶解肿瘤细胞亚系的能力。如果克隆能够裂解一个亚系,但不能裂解另一个亚系,则通过用源自抗原阳性肿瘤细胞的 cDNA 文库转染抗原阴性靶细胞来鉴定由前者表达的抗原。根据 CTL 克隆裂解转染 TAA 的靶细胞的能力,分离编码靶抗原 (TAA) 的 DNA。 乙) 在 SEREX 方法中,由从自体肿瘤细胞中分离出的 cDNA 组成的表达文库被克隆到原核表达载体中。来自癌症患者的血清样本(应包含识别 TAA 的抗体)用于筛选这些文库。然后分离和测序被抗体结合的克隆。其他鉴定 TAA 的方法包括 (C) 酸洗脱肿瘤细胞中 MHC 结合的肽,随后筛选肽级分以供癌症患者的 T 细胞识别,以及 (D) 基因表达微阵列分析肿瘤中上调的 RNA 转录物细胞与正常细胞的比较。
一旦确定了 TAA,重要的是确定该蛋白质中可以被各种 TCR 识别的肽序列。一种常见的方法是鉴定可由 HLA-A0201 分子呈递并被人类 T 细胞识别的肽(Kawashima 等,1998)。HLA-A0201 在白种人中很普遍,并且通常是研究的焦点,涉及结合此 HLA 分子的独特肽。首先,鉴定了含有预计会结合 HLA-A0201 分子的氨基酸基序的肽。使用 MHC 结合测定验证了结合 HLA-A0201 的能力。然后测试这些肽从 HLA-A*0201 阳性供体的外周血 T 细胞群中扩增肽特异性 T 细胞的能力。这些扩增是通过用暴露于目标肽的自体 DC 刺激 T 细胞来实现的。在多轮肽刺激后,测试扩增的 T 细胞溶解肽包被的靶细胞的能力。使用这种方法,鉴定了 MAGE-A2、MAGE-A3、癌胚抗原 (CEA) 和人表皮生长受体 (HER)-2/neu 蛋白的多种免疫原性肽。免疫原性 TAA 衍生肽的数据库可在 www.cancerimmunity.org 。
4.1.2 肿瘤相关抗原的类型
TAA 可分为几大类:(a) 突变抗原,(b) 癌睾丸抗原,(c) 分化抗原,(d) 过表达抗原,(e) 病毒抗原, (f) 具有独特翻译后修饰的抗原(图 21-10)
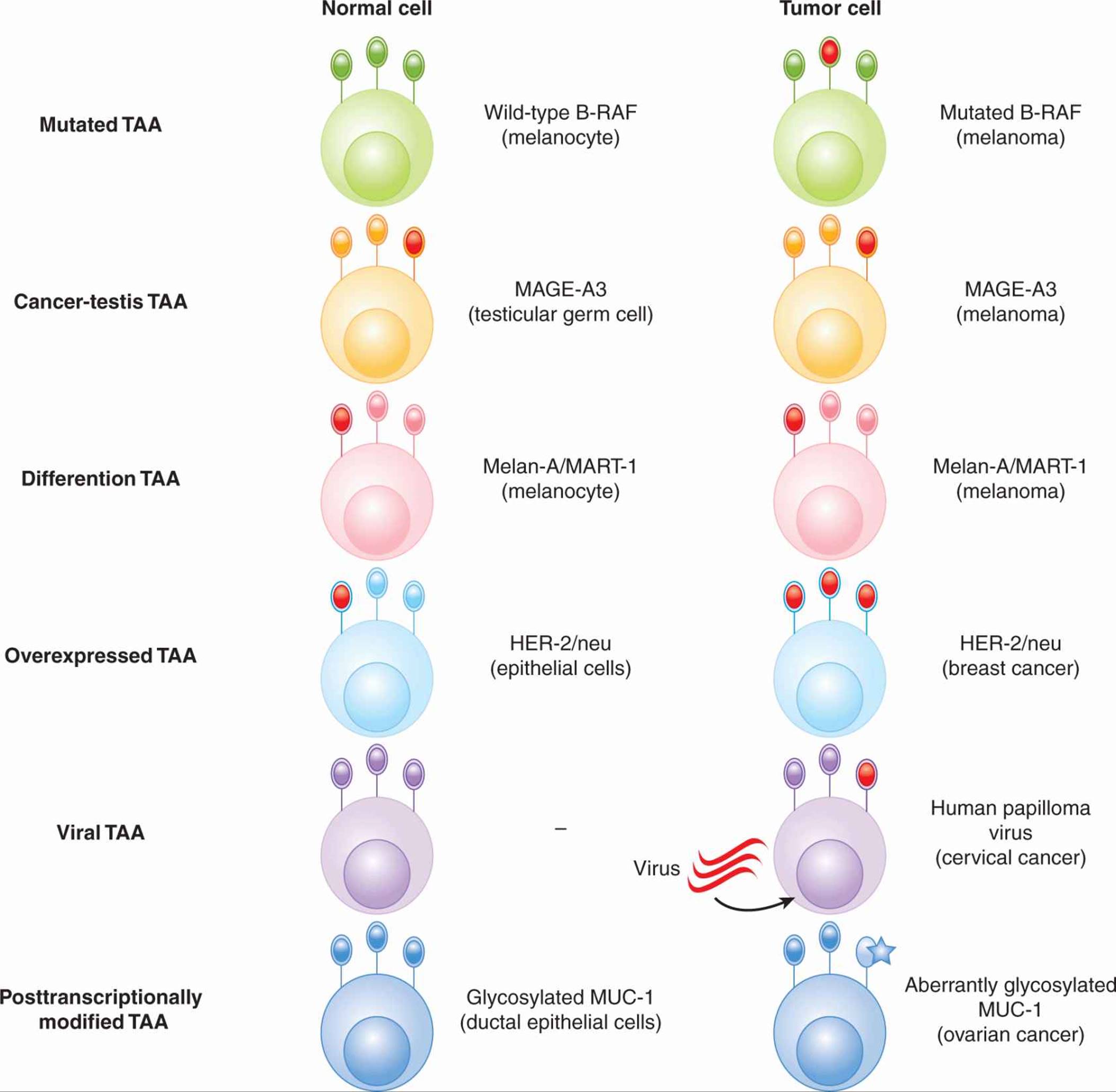
图 21-10 肿瘤相关抗原 (TAA) 的类型。 描述了各种类别的 TAA,并给出了每种类型的 TAA 的示例。显示了在正常细胞和肿瘤细胞上的表达。TAA 用红色表示。
突变抗原通常是含有个别患者独有的突变的蛋白质,尽管某些突变是一部分患者所共有的。例如,大约 2% 的实体瘤和 40% 至 60% 的黑色素瘤表达致癌蛋白 B-RAF 的突变形式(参见 第 7 章, 第 7.5.5 节)。绝大多数患者在第 600 位有缬氨酸 → 苯丙氨酸氨基酸取代。突变抗原不一定被 T 细胞识别为独特的,但它们可以作为其他治疗方法(例如,蛋白激酶抑制剂)的靶标。
癌症睾丸抗原的表达仅限于肿瘤细胞和正常胎盘滋养细胞和睾丸生殖细胞,因此代表了免疫治疗的有吸引力的靶点。癌症睾丸抗原包括 MAGE、BAGE 和 GAGE 蛋白,以及通常表达的 NY-ESO-1。
分化抗原是在正常组织和源自特定组织的肿瘤上表达的蛋白质。例如,Melan-A/MART-1 在正常黑色素细胞和恶性黑色素瘤上表达。CEA 在正常结肠上皮以及许多肠道癌中表达。其他分化抗原包括 gp100(黑色素瘤)、酪氨酸酶(黑色素瘤)和前列腺特异性抗原(PSA-前列腺癌)。分化抗原还包括癌胎抗原,例如甲胎蛋白,其在胎儿发育过程中在各种组织中表达并在肿瘤上重新表达。
过表达的 TAA 在各种正常组织以及肿瘤细胞上都有表达,但在肿瘤细胞上的表达更高。例如,Wilms 肿瘤-1 (WT-1) 在一定比例的乳腺癌、肺癌和其他肿瘤细胞中表达。
病毒 TAA 由病毒转化诱导的肿瘤表达。这包括爱泼斯坦-巴尔病毒 (EBV) 诱发的肿瘤,例如某些淋巴瘤和鼻咽癌,以及人乳头瘤病毒 (HPV) 诱发的宫颈瘤(参见 第 6 章)。
另一类 TAA 由蛋白质组成,与肿瘤细胞相比,这些蛋白质在正常细胞中发生的翻译后修饰不同。T 细胞能够区分具有不同翻译后修饰(例如不同糖基化水平)的相同肽。例如,与正常细胞相比,肿瘤细胞中的粘蛋白 1 (MUC-1) 蛋白通常在肿瘤细胞中糖基化过低。此外,肿瘤相关 MUC-1 上的糖部分往往更短。
4.2 人类肿瘤相关抗原特异性 T 细胞
MHC/肽多聚体试剂的开发使直接检测各种 TAA 特异性 T 细胞成为可能。该试剂通常由可溶性 MHC I 类分子(例如 HLA-A*0201)与感兴趣的肽(例如,源自已知结合特定 HLA 等位基因的肿瘤相关蛋白的肽)折叠在一起(图. 21–11)。每个 MHC 分子都用一个生物素分子共价标记。然后使用链霉亲和素将多个 MHC/肽复合物聚集在一起,链霉亲和素具有 4 个生物素结合位点。该试剂的多聚性质允许与特定 TCR 的更高亲和力结合,并且可以通过荧光染料偶联的链霉亲和素部分的流式细胞术分析检测任何结合的细胞。第一个报道的多聚体是使用 HIV 和 A 型流感衍生的肽合成的(Altman 等,1996)。尽管 MHC/肽多聚体也已使用 MHC II 类分子和 II 类结合肽构建,但它们通常不如 MHC I 类衍生的多聚体(Vollers 和 Stern,2008)。
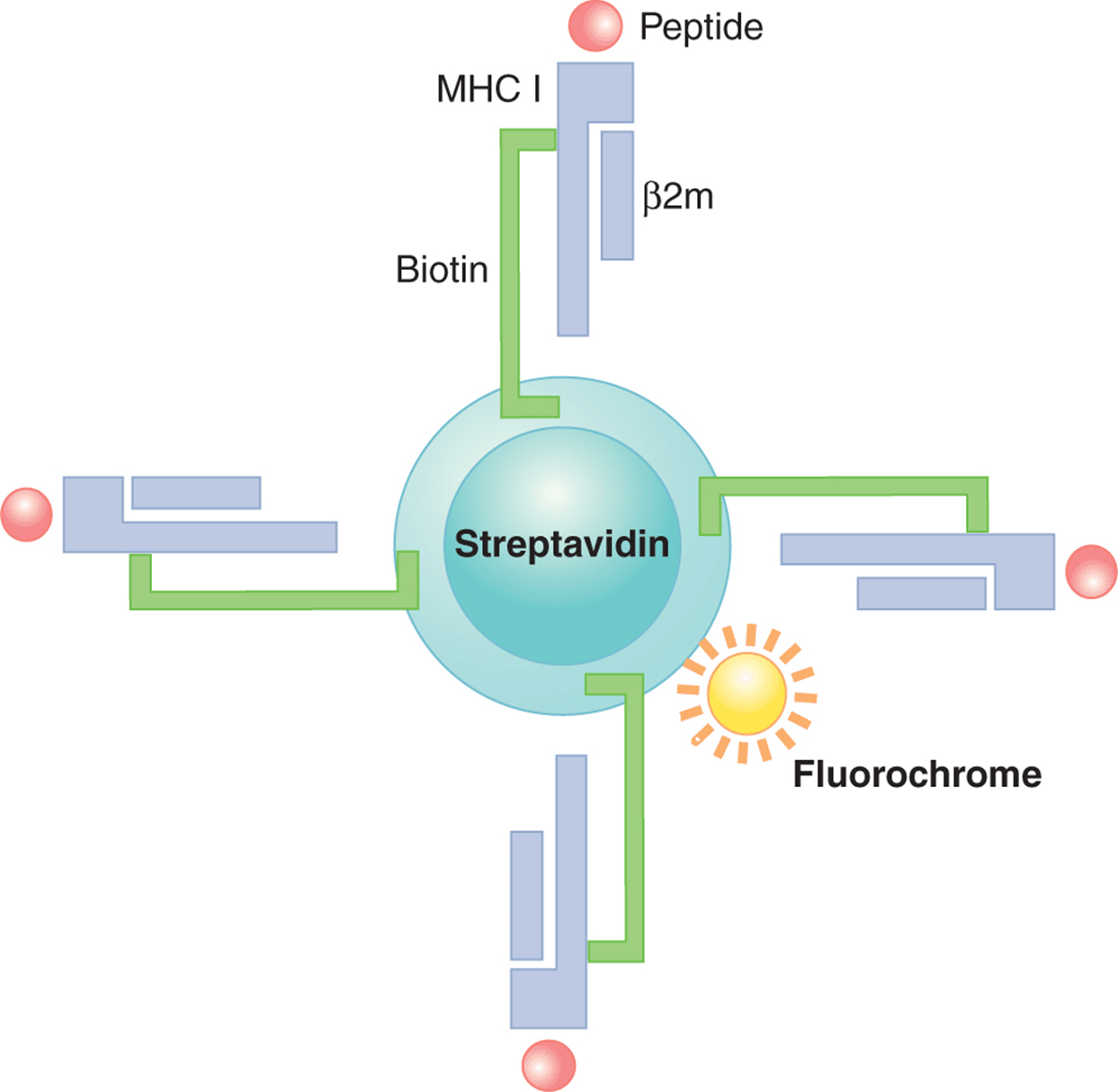
图 21-11 MHC/肽多聚体的结构。 描绘了 MHC/肽四聚体,其中 4 个 MHC I 类/肽复合物复合在一起。每个 MHC I 类分子都经过生物素化;每个生物素化的 MHC I 类/肽复合物通过生物素分子与链霉亲和素分子结合,并且链霉亲和素分子与荧光染料结合。这些试剂有助于监测肿瘤特异性 T 细胞反应。
使用 HLA-A*0201 MHC/肽多聚体的早期研究能够识别可以识别黑色素瘤相关抗原的外周 T 细胞的存在。这些肿瘤特异性 T 细胞可以直接离体检测,无需使用特定肽进行体外刺激或扩增。通过肿瘤浸润淋巴结的离体染色检测对黑色素瘤相关抗原 Melan-A/MART-1 和酪氨酸酶特异的 T 细胞(Romero 等,1998)。MHC/肽多聚体还用于通过荧光激活细胞分选 (FACS) 分离特定 T 细胞,并且发现这些细胞具有功能性,因为它们可以在体外裂解自体黑色素瘤肿瘤细胞(Romero 等,1998)。
肿瘤特异性 T 细胞的存在和功能也已在其他癌症中得到证实。大量研究表明,一些患有乳腺癌的女性对乳房 TAA 具有预先存在的免疫力。在一项研究中,13 名乳腺癌患者中有 7 名在诊断时具有可检测到的肿瘤特异性 T 细胞反应(Rentzsch 等,2003)。这种反应是通过评估 IFN-γ RNA 转录物对来自乳腺癌表达的几种常见抗原的肽刺激的反应来证明的:MUC-1、HER-2/neu、CEA、NY-ESO-1 和 SSX -2. HER-2/neu 由多种癌症表达,并且已经在表达 HER-2/neu 的癌症(乳腺癌、卵巢癌、肺癌、结肠直肠癌、前列腺癌)的患者中证明了对 HER-2/neu 的预先存在的免疫力(Sotiropoulou 等, 2003)。
显然,对肿瘤的免疫耐受是不完全的,因为可以在癌症患者中检测到 TAA 特异性 T 细胞。这些肿瘤特异性 T 细胞是否可以介导抗肿瘤活性,以及如何通过治疗干预诱导它们这样做,是成功开发免疫疗法的主要挑战。
4.3 免疫监测
从历史上看,即使在没有治疗干预的情况下,免疫系统也会检查身体并瞄准肿瘤细胞的“免疫监视”概念并不总是被接受。反对免疫监视的早期研究检查了携带“裸体”突变且缺乏胸腺并被认为是免疫缺陷的小鼠的肿瘤发展(Stutman,1974,1979)。发现裸鼠以与野生型小鼠相似的频率发生致癌物(甲基胆蒽 [MCA])诱导的和自发性肿瘤,并得出结论,免疫系统在抑制肿瘤进展方面没有发挥作用。已经确定了可能影响该模型解释的几个因素。首先,现在已知裸鼠仍有一些完整的免疫细胞。第二,先天免疫系统(在裸鼠中完好无损)在抗肿瘤免疫中的重要性已经确立。第三,上述研究中使用的裸鼠的遗传背景(CBA/H 背景)表达了代谢 MCA 的酶的特定同种型。因此,裸鼠可能对 MCA 诱导的肿瘤形成更具抵抗力,这可能掩盖与免疫反应受损相关的任何后果。
许多研究为支持癌症免疫监视提供了强有力的证据(Dunn 等,2004)。使用各种免疫缺陷小鼠表明免疫系统消除了肿瘤细胞:(a)缺乏 Rag 蛋白的小鼠,因此缺乏所有 T 和 B 细胞,(b)缺乏免疫刺激细胞因子干扰素-γ(IFN- γ 受体 1 基因敲除小鼠),和(c)缺乏 IFN-γ 受体信号下游关键细胞内信号分子的小鼠(Statl 基因敲除小鼠)。与免疫活性小鼠相比,这些免疫缺陷小鼠以更高的频率和更快的动力学发展出 MCA 诱导的自发性肿瘤(Kaplan 等,1998;Shankaran 等,2001)。已经提出了一个模型来描述免疫反应在肿瘤进展的各个阶段的作用,包括三个阶段:消除、平衡和逃逸(Dunn 等,2004)(图 21-12)。
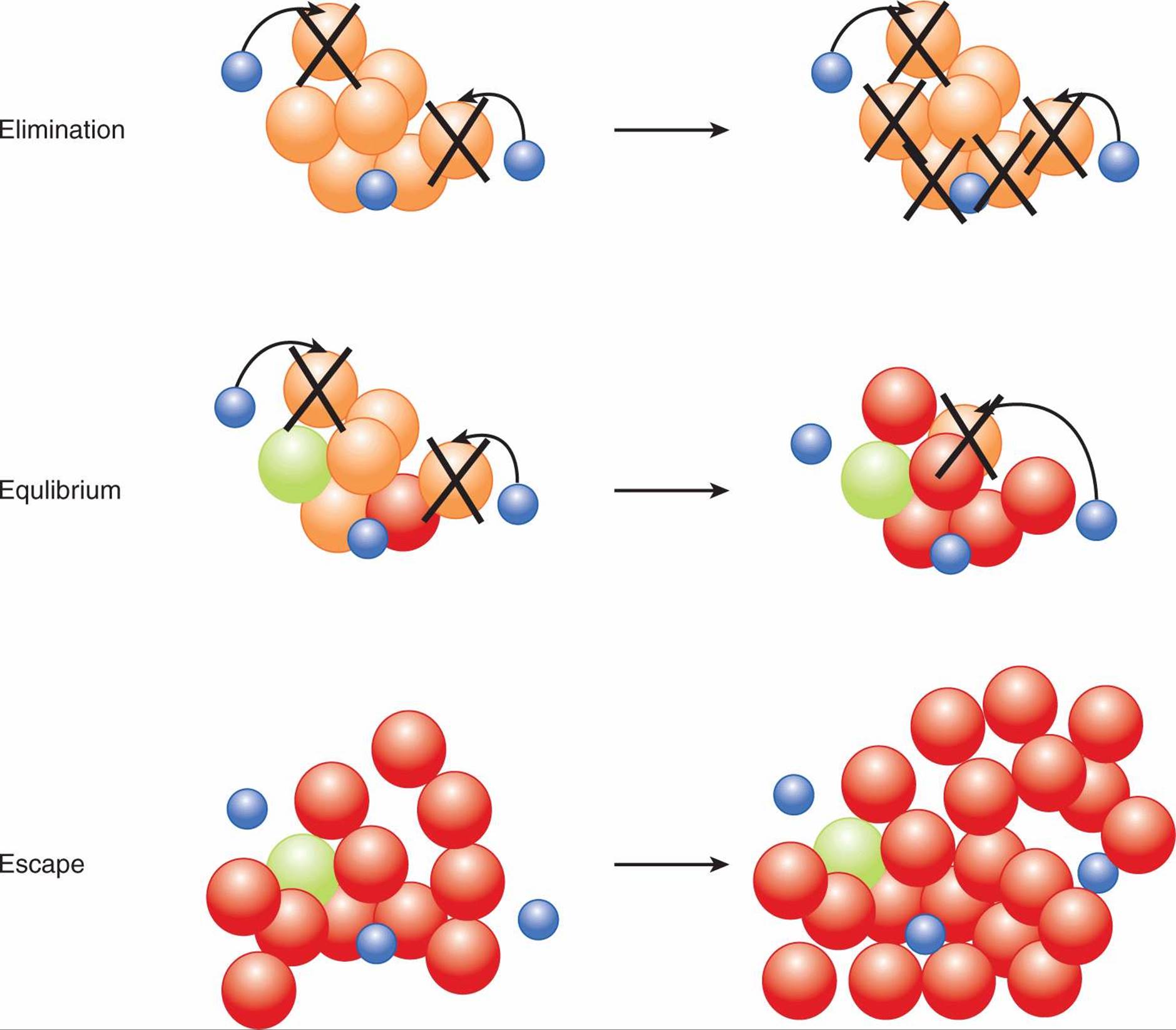
图 21-12 癌症免疫编辑的三个 E。 在 Dunn 等人 (2004) 提出的模型中,免疫编辑由 3 个主要阶段组成。在 消除阶段,免疫系统识别肿瘤细胞并介导它们的消除。在 平衡阶段,免疫系统和肿瘤处于动态平衡状态,其中肿瘤细胞的基因组不稳定性和抗肿瘤免疫反应施加的选择压力相结合,导致编辑或“雕刻”肿瘤细胞群。免疫系统消除某些肿瘤细胞导致选择免疫原性较低的肿瘤。在 逃生阶段,出现足够多的肿瘤细胞变异,以至于肿瘤可以逃脱免疫系统的清除。 蓝色,免疫细胞; 橙色/绿色/红色,肿瘤细胞。
在免疫监视的消除阶段,免疫系统识别肿瘤细胞并对肿瘤产生反应。在平衡阶段,免疫系统和肿瘤处于动态平衡状态,其中肿瘤细胞的基因组不稳定性和抗肿瘤免疫反应施加的选择压力相结合,导致编辑或“雕刻”肿瘤细胞群。免疫系统消除某些肿瘤细胞导致选择免疫原性较低的肿瘤。在逃逸阶段,出现了足够多的肿瘤细胞变异,以至于肿瘤可以逃避免疫系统的清除。逃逸可能部分是肿瘤细胞免疫原性降低的结果,例如 TAA 表达降低或 MHC I 类下调,但是有许多机制可以使肿瘤逃避免疫系统。这些机制包括负调节免疫细胞类型、肿瘤细胞产生的免疫抑制因子以及抑制 T 细胞反应的表面受体。
4.4 T 细胞浸润和疾病预后
T 细胞免疫在减少人类临床肿瘤负担方面的重要性部分通过评估肿瘤组织被免疫细胞浸润的研究得到强调。在对肿瘤组织进行免疫组织化学或基因表达分析的许多研究中,数据显示免疫细胞(尤其是 T 细胞)浸润与更好的预后之间存在关联(例如,Galon 等,2006;Tuthill 等,2002;Zhang 等) al,2003 年)。
在此类研究的一个示例中,对 75 个结直肠肿瘤进行了 RNA 表达的基因组分析(Galon 等,2006)。一组 Th1 相关基因的表达水平显示出与肿瘤复发在统计学上显着的负相关,因此表明 Th1 反应抑制了人类肿瘤的进展。在同一研究中,还对由 415 个结直肠肿瘤构建的石蜡包埋组织微阵列中的免疫细胞浸润进行了免疫组织化学。与复发患者相比,未复发患者的 CD3+ T 细胞、CD8+ T 细胞、颗粒酶 B(一种由裂解性 T 细胞产生的细胞毒性颗粒)和 CD45RO(一种 T 细胞活化标志物)的密度较高。在多变量分析中,肿瘤中 CD3+ 细胞的密度被证明是一个独立的预后因素,并且这些 T 细胞标志物被证明是比基于组织病理学的标准分期方法更好的患者生存预测指标。
4.5 抑制抗肿瘤免疫的屏障
尽管有证据表明免疫系统可以对肿瘤细胞产生反应,但很难估计抗肿瘤免疫在肿瘤进展中的相对重要性。然而,很明显,当肿瘤发展时,免疫反应无法控制肿瘤的生长。各种机制可能导致免疫介导的肿瘤控制失败;它们中的许多是防止自身免疫从而抑制针对自身组织的免疫反应的相同机制。上文讨论了外周T细胞耐受的各种机制(见第21.3.7节):在各种模型中,T细胞缺失、T细胞无能以及负调控细胞和分子的功能都已被证明对肿瘤的免疫反应具有负面影响。此外,已知肿瘤细胞或肿瘤浸润免疫细胞产生的因子抑制抗肿瘤T细胞反应。肿瘤相关免疫抑制因子的两个例子是TGF-β和IDO。
TGF-β由肿瘤相关巨噬细胞、肿瘤细胞和Tregs产生。它对多种细胞类型发挥免疫抑制作用,包括DC和效应T细胞。DC中的TGF-β信号传导导致MHC II类、CD40、CD80和CD86的下调,以及促炎细胞因子IL-12、干扰素(IFN)-α和肿瘤坏死因子(TNF)-α的抑制。因此,TGF-β在DC中诱导耐受表型。这些耐受性DC本身已被证明能分泌TGF-β,从而在小鼠和人类模型中诱导Tregs。TGF-β对T细胞的免疫抑制作用也是公认的。TGF-β信号传导导致CTL中颗粒酶A、颗粒酶B和FAS配体的抑制。此外,iTregs可由TGF-β产生。
已经对旨在阻断TGF-β作用的各种药物进行了临床试验(Flavell等人,2010)。阻断策略包括小分子抑制剂、反义分子的递送和阻断抗体的使用。临床反应有限,但进一步研究这些策略的免疫效果以及TGF-β阻断与其他免疫治疗策略的结合可能会改善反应。
IDO是一种重要的免疫抑制介质(Munn和Mellor,2007)。IDO是一种参与色氨酸氧化分解代谢的酶,由于色氨酸对T细胞增殖和活化很重要,IDO消耗色氨酸会抑制T细胞反应。在患有各种癌症的患者中发现了分泌IDO的DC,包括黑色素瘤、癌症和癌症(Munn等人,2002)。在肿瘤引流淋巴结中也发现了分泌IDO的DC,此外,这些分泌IDO DC可以在体内诱导肿瘤特异性T细胞的无能。黑色素瘤患者肿瘤引流淋巴结中IDO的免疫组织学检测显示,IDO的表达与不良预后相关(Lee等人,2005;Munn等人,2004年)。肿瘤细胞也可以分泌IDO。
了解肿瘤特异性T细胞无法控制肿瘤生长的机制可能成为设计治疗策略的基础。例如,无反应的肿瘤特异性T细胞可能需要体外挽救,然后再使用;负调控分子可能需要被阻断;或者可能需要补充缺失的肿瘤特异性T细胞。肿瘤微环境中存在的免疫抑制分子可能也需要被抑制。这些方法的结合很可能会产生最有效的免疫治疗方法。
五、免疫疗法
5.1免疫治疗方法介绍
我们对肿瘤免疫学的理解不断提高,导致越来越多的免疫治疗剂被批准用于治疗癌症。一大类试剂由单克隆抗体(mAbs)组成。尽管各种mAb的作用机制并不总是与上文所讨论的抗肿瘤T细胞反应有关——许多功能完全独立于T细胞——但它们在癌症治疗中发挥着重要作用。
旨在增强抗肿瘤T细胞免疫的免疫疗法可大致分为(a)非特异性免疫疗法、(b)特异性免疫疗法和(c)过继细胞疗法。每一类都包含许多不同的策略——有些是研究性的,有些是批准用于治疗的。表21-1列出了本章中选择讨论的少数策略。
TABLE 21–1 Selected approaches to cancer immunotherapy.
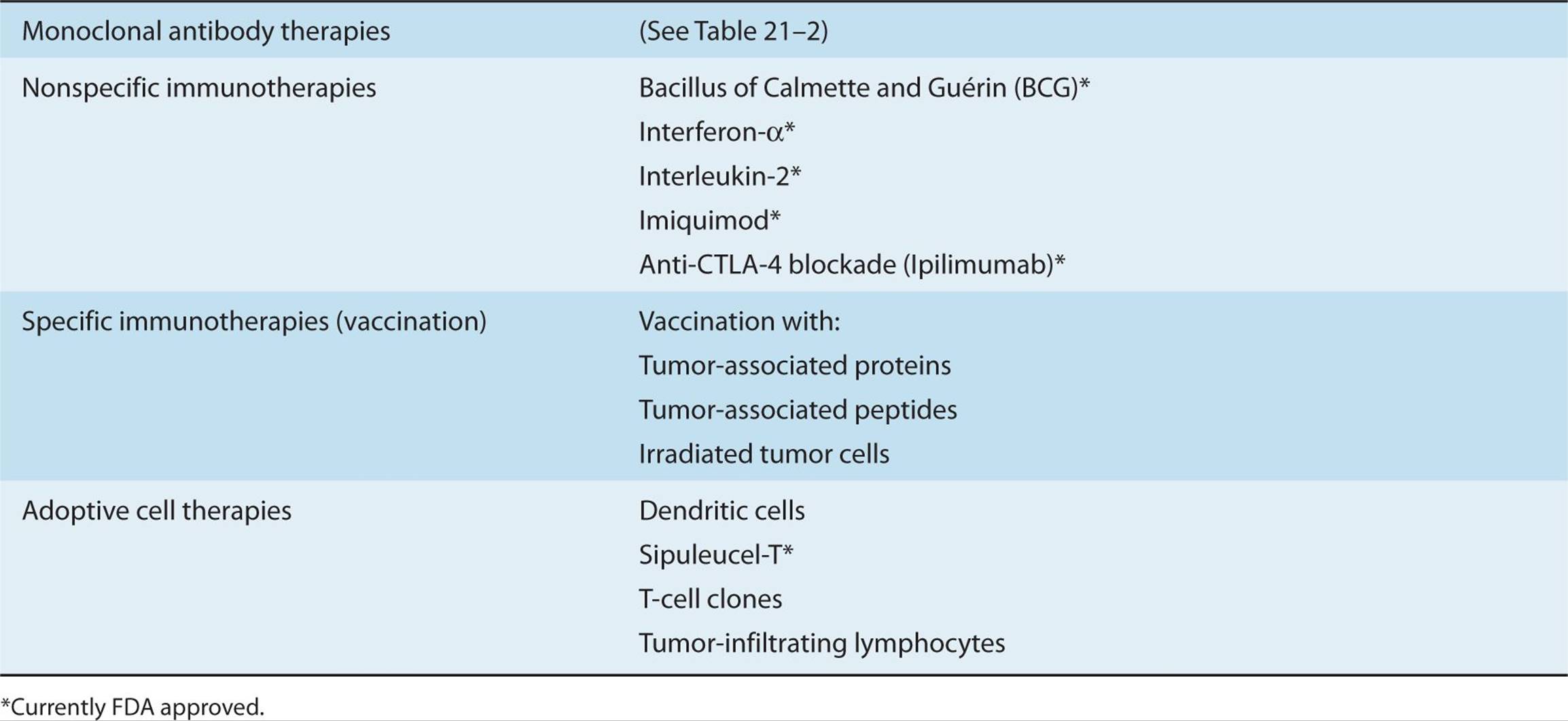
非特异性免疫疗法是指以“非特异性”或“多克隆”的方式增强一般T细胞反应的策略。非特异性免疫疗法包括使用细胞因子(如INFα、IL-2)、免疫佐剂(咪喹莫特)和靶向免疫调节分子的药物(抗CTLA-4抗体)。特异性免疫治疗侧重于通过使用疫苗策略激活和增强能够识别TAA的T细胞数量。尽管通过疫苗接种诱导免疫反应通常指的是一种预防策略,例如用于限制病毒感染的策略,但疫苗接种也可能指的是旨在引发抗肿瘤免疫反应以消除已确定癌症的治疗。本章将不涉及预防性癌症疫苗领域,但Lollini等人(2006)对此进行了综述。常见的疫苗方法包括使用TAAs或衍生自TAAs的肽。其他方法基于使用全肿瘤细胞(自体或同种异体)进行疫苗接种,这些细胞在输注前已被照射以防止其在输注后增殖。在过继细胞治疗中,自体免疫细胞(如DC和T细胞)在离体操作,然后再使用。
5.2用于癌症治疗的单克隆抗体
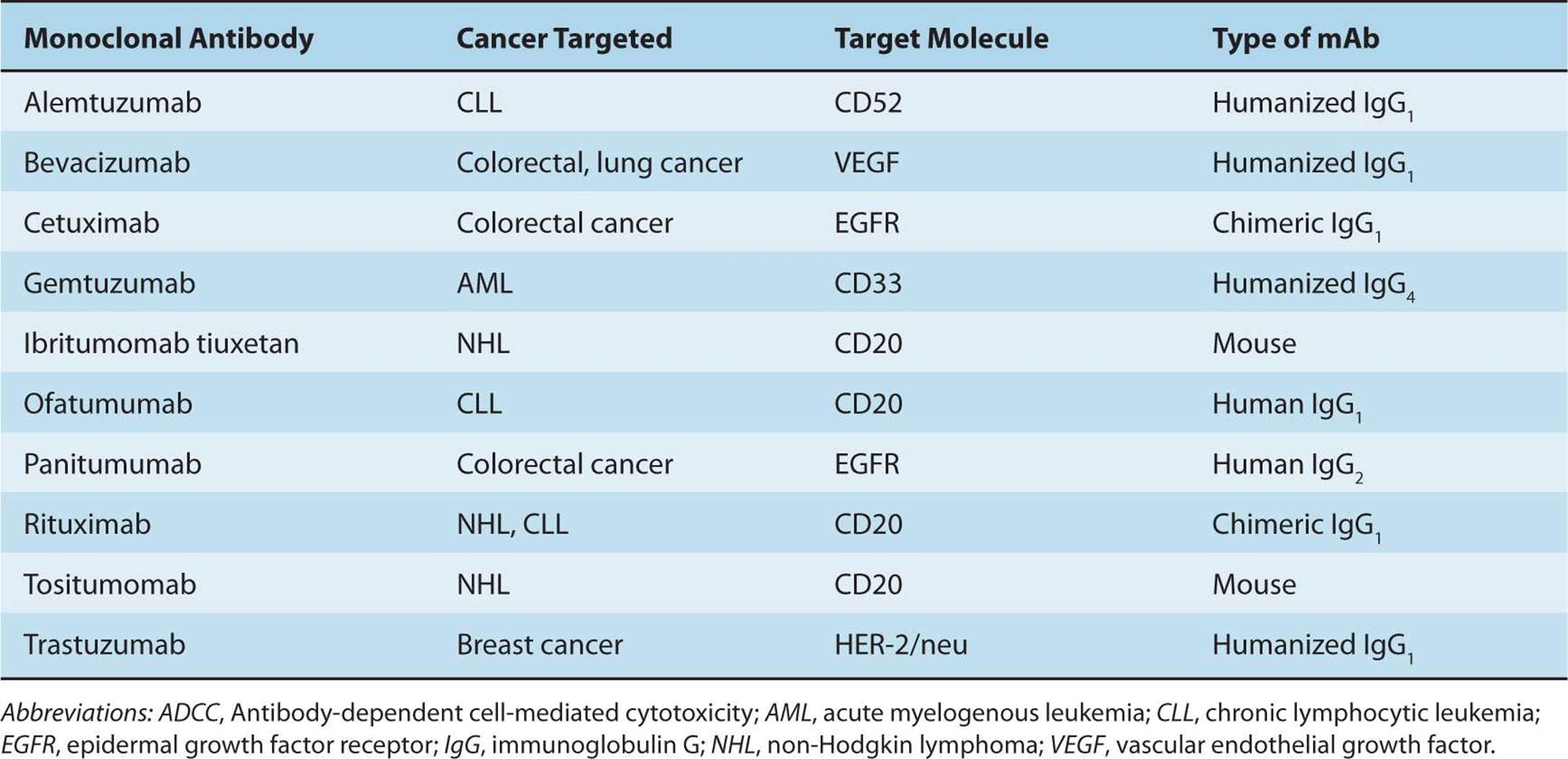
单克隆抗体(mAb)与其靶蛋白特异性结合,可以阻断靶蛋白的功能,触发靶蛋白下游的信号传导,或将偶联毒素递送至表达靶蛋白的细胞。目前美国食品药品监督管理局(FDA)批准的单克隆抗体包括靶向肿瘤细胞表达的抗原(如非霍奇金淋巴瘤和慢性淋巴细胞白血病上的CD20)、促进肿瘤生长的分子(如表皮生长因子受体)或血管生成分子(如血管内皮生长因子)的单克隆抗体。表21-2列出了被批准用于癌症治疗的抗体实例。
TABLE 21–2 Table of monoclonal antibodies approved for cancer therapy.
5.2.1单克隆抗体的产生
识别给定蛋白质靶标的mAb来源于单个B细胞产生的抗体分子。最初,单克隆抗体是通过将来自用靶蛋白免疫的动物脾脏的B细胞与因无法产生免疫球蛋白而被选择的骨髓瘤细胞系融合而产生的。原代脾细胞不能在未补充的培养基中离体存活。骨髓瘤细胞系也被选择用于酶(次黄嘌呤鸟嘌呤磷酸核糖转移酶[HGPRT])的缺乏,该酶使细胞无法在含有次黄嘌呤、氨基蝶呤和胸苷(HAT)的培养基中生长。因此,可以通过在含HAT的培养基中培养来选择脾细胞(表达HGPRT)和骨髓瘤细胞之间的成功细胞融合。然后克隆融合细胞:将细胞以有限的数量接种,并分别扩增单个细胞。然后筛选这些融合细胞(称为杂交瘤)分泌的抗体,这些抗体可以结合感兴趣的靶蛋白。一旦鉴定出具有所需抗体特异性的杂交瘤,就可以通过在培养物中扩增杂交瘤,或在动物(小鼠、兔子)的腹膜腔中扩增杂交细胞并收集腹水来生产大批量抗体。这种经典的抗体生产方法的示意图,以及下面描述的基于遗传方法的当前方法的示例,如图21-13所示。
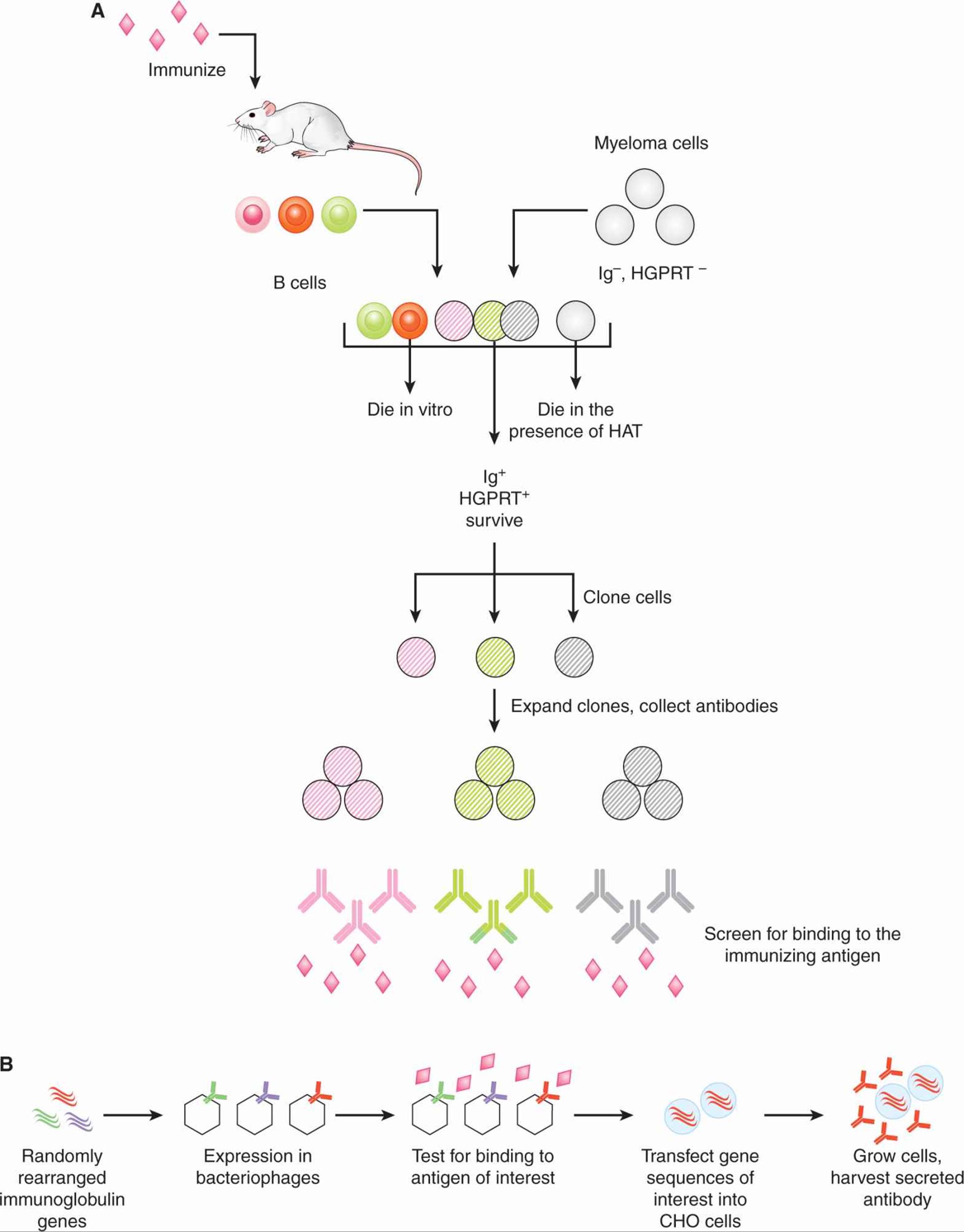
FIGURE 21–13 Methods of monoclonal antibody production. A) mAbs were initially produced by the fusion of B cells with a specialized myeloma cell line. Fused cells were cloned and then the clone that produced the antibody of interest was selected for antibody production. Further details are provided in the text. B) Other methods are based on recombinant technologies, where the desired antibody genes are transfected into cells such as Chinese hamster ovary (CHO) cells and antibodies are harvested from culture supernatants. In this example, the antibody genes of interest are identified by screening bacteriophages for binding to the antigen of interest. The bacteriophages have been engineered to express antibodies that are the product of random rearrangement of immunoglobulin genes.
5.2.2 治疗性抗体的类型
识别人类蛋白质的抗体最初是通过用人类蛋白质免疫动物(如小鼠)和分离特异性抗体产生的,如上文杂交瘤方法中所述。然而,由于几个原因,小鼠抗体的治疗价值有限。首先,小鼠Fc结构域(是在特定类别的所有抗体中保守的抗体的“恒定”结构域)不能像人类Fc结构区那样被人类免疫细胞有效识别,并且这种识别对于抗体治疗的一些作用机制是必需的,如下所述。此外,小鼠抗体被人类免疫系统识别为外源蛋白,因此重复给予抗体将导致针对治疗性抗体的免疫反应。一种解决方案是产生嵌合抗体,所述嵌合抗体经改造以包含来自小鼠抗体的可变(Fv)区和人恒定(Fc)区。另一种方法是产生人源化抗体,其中可变抗原结合结构域(Fv)的高变区来源于小鼠抗体,其余Fv和整个Fc区来源于人类序列。为了用异种序列完全绕过中和抗体,目前许多治疗性抗体都是完全人类的。这些抗体可以从被改造为仅表达人类抗体的小鼠中分离,也可以通过噬菌体展示方法分离,其中人类抗体基因的随机重组文库在噬菌体中表达。然后对表达抗体的噬菌体进行结合靶蛋白的能力筛选。重组抗体通常通过用所需的抗体基因转染中国仓鼠卵巢(CHO)细胞来产生,因为CHO细胞在悬浮培养中生长良好。图21-14说明了这些类型的抗体。

FIGURE 21–14 Chimeric and humanized antibodies. In chimeric antibodies, the variable fragment (Fv) of the antibody molecule is of mouse origin and the constant regions (Fc) is of human origin. In humanized antibodies, only the hypervariable region of the Fv is of mouse origin; the rest of the antibody molecule is of human origin.
5.2.3抗体的作用机制
与细胞表面受体结合的抗体可以阻断受体信号传导(通过配体结合的立体阻断)或可以触发受体信号转导(通过多种受体的聚集)。抗体还可以导致表达抗体靶向分子的细胞裂解。靶细胞裂解可以通过激活补体蛋白级联或启动抗体依赖性细胞介导的细胞毒性(ADCC)来发生(图21-15)。补体级联反应是由免疫球蛋白(Ig)G的Fc结构域与补体蛋白结合启动的,然后导致各种补体系统蛋白的级联裂解。这种级联的最终结果是在靶细胞(在这种情况下是肿瘤细胞)上形成一种称为膜攻击复合物(MAC)的蛋白质复合物,导致靶细胞的孔形成和裂解。补体级联激活的其他蛋白质能够介导各种免疫细胞对肿瘤部位的化学吸引。另一方面,ADCC是在抗体的Fc区被Fc受体(FcRs)结合时启动的。FcRs在各种先天免疫细胞类型上表达,并且FcRs的激活导致针对靶细胞的细胞毒性活性的激活。例如,FcγRIIIA由自然杀伤细胞(NK)表达,IgG分子的Fc区与该受体的结合激活NK细胞介导的靶细胞裂解。曲妥珠单抗(赫赛汀)主要被认为通过HER-2/neu生长受体结合和抑制信号传导(见第7章第7.5.3节和第20章第20.3.3节),也已被证明通过ADCC介导抗肿瘤活性(Clynes等人,2000)。由于ADCC是介导治疗性抗体作用的潜在重要机制,因此应设计或选择最有效的抗体,使其与激活的FcRs结合良好,而与抑制性FcγIIB结合较差(Nimmerjahn和Ravetch,2008)。
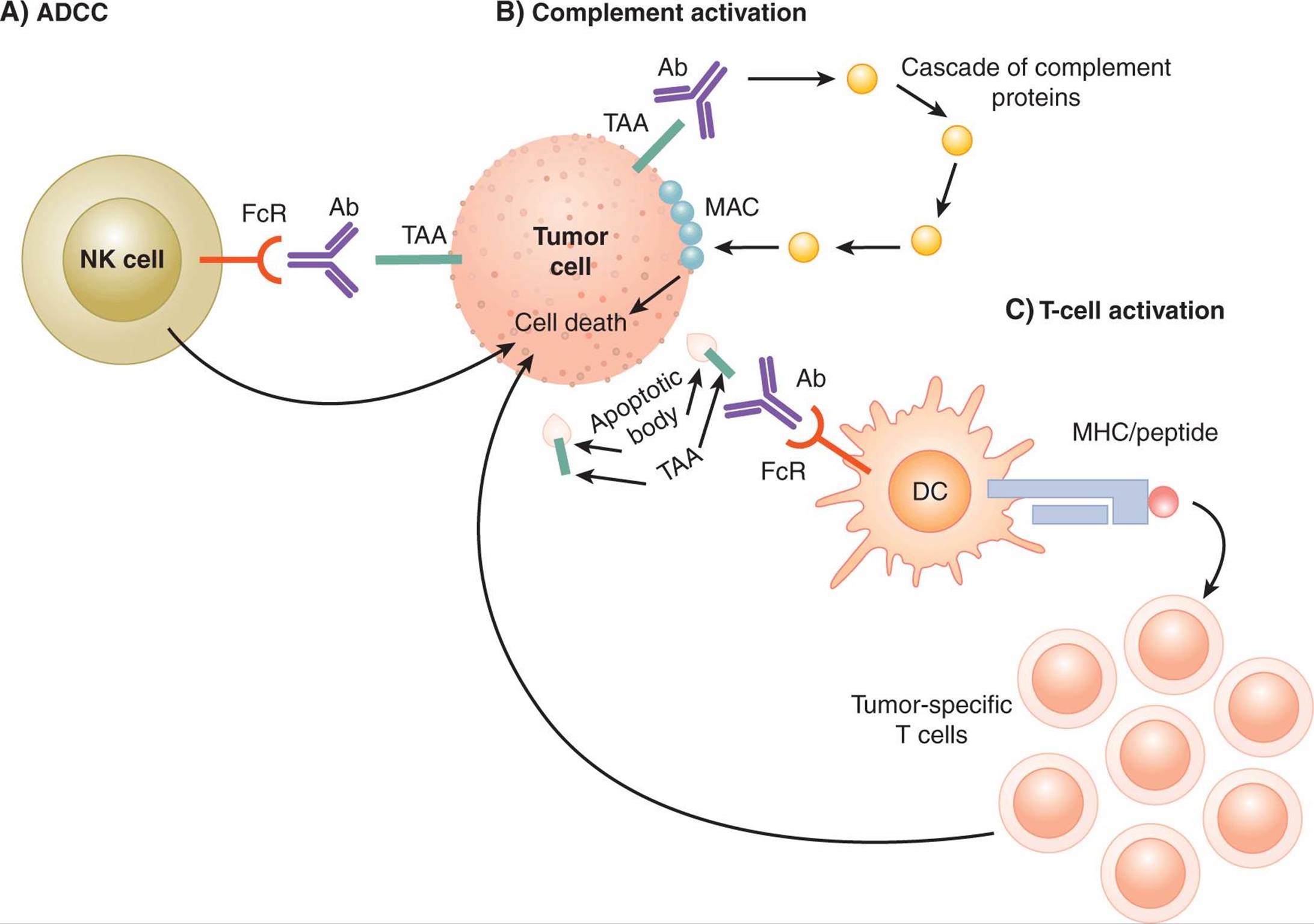
FIGURE 21–15 Tumor-specific antibodies can promote tumor regression by multiple mechanisms. In addition to either blocking or triggering cell-surface receptors, antibodies can lead to immune-mediated elimination of tumor cells. A) ADCC is induced when antibodies bound to tumor antigens (TAA) on the surface of tumor cells are then bound by Fc receptors expressed by natural killer (NK) cells. Triggering of the Fc receptors activates the cytolytic activity of NK cells. B) Complement activation is induced by binding of complement proteins to the Fc domain of antibody/antigen complexes. One of the end results of the complement cascade is the formation of the membrane attack complex (MAC) in the cell membrane of target cells, leading to cell death. C) Antibodies can also bind to tumor antigens present on apoptotic bodies formed when tumor cells undergo apoptosis during the normal cycle of proliferation and cell death. By this route, tumor antigens are taken up by DCs via Fc receptors. Tumor antigens can be processed by the DCs and presented as peptide/MHC complexes to T cells. Tumor-specific T cells can then be activated and mediate antitumor activities including cytotoxic activity against tumor cells.
抗体也可能导致增强的T细胞启动。在肿瘤进展的自然过程中或在抗体介导的肿瘤细胞裂解过程中,垂死肿瘤细胞的片段可以被TAA特异性抗体识别并结合(见图21-15)。然后,这些复合物可以被DC上表达的FcRs识别、内化,以及通过交叉呈递呈递给肿瘤特异性T细胞的TAA衍生肽。这些不同机制对各种抗体的相对作用尚不清楚。
5.2.4 修饰抗体
抗体可以通过各种方式进行修饰,以改变其治疗功能。例如,双特异性T细胞接合剂(BiTE)分子由2个Fv片段组成,每个片段具有不同的特异性,通过柔性接头连接在一起(Wolf等人,2005)。例如,已经产生了对CD3和上皮细胞粘附分子(EpCAM)具有特异性的BiTE。EpCAM特异性成分结合表达这种常见肿瘤粘附分子的肿瘤细胞,CD3特异性成分的功能是将T细胞募集到表达EpCAM的肿瘤细胞。另一个例子是Blinatumomab,它已被证明可以介导非霍奇金B细胞淋巴瘤的消退(Bargou等人,2008)。该试剂对CD19(在非霍奇金淋巴瘤细胞上表达)和CD3(将T细胞募集到肿瘤细胞)具有特异性。
三种经FDA批准的癌症抗体已被修饰,可向肿瘤细胞输送有毒或放射性分子。Gemtuzumab与毒素ozogamicin融合,Ibritumomab tiuxetan与钇-90缀合,Tositumomab与碘-131缀合(Bross等人,2001;Fisher等人,2005;Witzig等人,2002)。
5.3 非特异性免疫调节剂
5.3.1 Calmette Guérin芽孢杆菌
卡介苗(BCG)是牛分枝杆菌的减毒活菌株,可有效预防浅表性膀胱癌的复发。BCG通过膀胱内给药,其作用机制与其免疫刺激活性有关(Patard等人,1998)。
将BCG滴入膀胱后,通过APC进行处理并局部呈现。然后这些APC刺激CD4和CD8 T细胞反应。此外,观察到尿路上皮细胞上MHC I类和II类的上调。在BCG治疗期间,在尿液中发现各种细胞因子的水平:治疗早期的IL-1、IL-6、IL-8和IL-10,治疗后期的IL-2、TNF-α和IFN-γ。治疗后还观察到T细胞浸润到膀胱壁中。总体而言,BCG滴注导致局部T细胞反应,其似乎具有Th1型反应的特征。肿瘤细胞被清除的机制尚不清楚。分枝杆菌特异性T细胞可能被激活并裂解已感染分枝杆菌的肿瘤细胞。BCG诱导的免疫刺激也可能促进膀胱肿瘤抗原特异性T细胞的活化,并且这些T细胞杀死肿瘤细胞。
5.3.2 干扰素-α
IFN-α由多种细胞类型产生,包括免疫系统的细胞,如T细胞、B细胞、NK细胞、DC和巨噬细胞,具有直接的抗肿瘤作用以及免疫调节作用(Dunn等人,2006)。IFN-α可直接抑制肿瘤细胞增殖,下调癌基因表达,诱导肿瘤抑制基因表达。它还具有抗血管生成活性。
IFN-α治疗在90%以上的毛细胞白血病患者中诱导反应,尽管大多数患者会在2年内复发。IFN-α在其他血液系统癌症患者中也显示出一些活性,如慢性粒细胞性白血病、骨髓瘤和低度非霍奇金淋巴瘤。尽管美国食品药品监督管理局批准用于黑色素瘤和肾细胞癌患者,但这些患者对IFN-α治疗的总体临床反应率相对较低。此外,高剂量IFN-α治疗与严重的毒性有关,包括低血压、呕吐、发烧和腹泻(Kirkwood等人,1996;Motzer等人,2002年)。
尽管IFN-α治疗的效用有限,但IFN-α是抗肿瘤免疫的重要增强剂。IFN-α诱导MHC I类的上调并有助于DC的成熟。它对于促进CD8 T细胞存活和增强T细胞向组织中的迁移也很重要。例如,用IFN-α受体阻断抗体治疗的小鼠不能排斥MCA诱导的肉瘤,而未经治疗的小鼠可能会排斥这种肉瘤。此外,IFN-α受体1缺陷小鼠更容易受到MCA诱导的肿瘤形成的影响(Dunn等人,2006)。IFN-α可能与其他类型的免疫疗法相结合具有治疗作用。例如,在结肠癌的小鼠模型中,使用免疫刺激性抗体(激动性抗CD137mAb)和IFN-α的联合治疗产生协同抗肿瘤免疫(Dubrot等人,2011)。
5.3.3 白细胞介素-2
IL-2是一种特性良好的细胞因子,主要起刺激T细胞和NK细胞增殖的作用。高剂量IL-2治疗是肾细胞癌和黑色素瘤的一种经批准的治疗方法,但对于这两种癌症类型,这种治疗的临床反应率仅在15%的范围内(Atkins等人,1999;Fyfe等人,1995)。高剂量IL-2治疗也与严重毒性有关,包括心律失常、导致低血压的毛细血管渗漏综合征、导致混乱的中枢神经系统毒性和腹泻等胃肠道毒性(Rosenberg等人,1989)。尽管IL-2促进效应T细胞反应并可逆转效应T细胞的无能,但IL-2可能不是促进免疫的理想试剂,因为它也促进Tregs的扩增。
5.3.4咪喹莫特 Imiquimod
咪喹莫特是一种触发TLR7分子的合成化合物。TLRs是一个由各种微生物上存在的保守分子基序刺激的分子家族(Akira等人,2006;另见第21.2.2节)。例如,TLR7的天然配体是单链RNA,它存在于一些病毒中。TLR由多种细胞类型表达,包括先天免疫系统的细胞,如巨噬细胞和树突状细胞。TLRs和相应配体之间的相互作用导致先天免疫细胞的激活,从而通过各种机制促进微生物的清除,包括产生干扰素和促炎细胞因子。
因为TLRs激活APC如DC,它们可以增强DC刺激抗肿瘤T细胞反应的能力。各种TLR配体正在癌症免疫疗法的动物模型和早期临床试验中进行研究。这些药剂通常与疫苗接种策略结合使用,以增强疫苗接种诱导的T细胞反应。
咪喹莫特被批准用于治疗浅表基底细胞癌,以及治疗生殖器疣和光化性角化病。治疗浅表基底细胞癌通常是有效的,完全清除率约为75%或更高(相比之下,安慰剂治疗组只有少数)。咪喹莫特已被证明可通过各种先天免疫细胞类型诱导促炎介质,如IFN-α、TNF-α和IL-6,包括巨噬细胞和一种称为浆细胞样DC的特殊DC亚群。咪喹莫特还上调浆细胞样DC上的共刺激分子和趋化因子受体,从而分别增强它们激活T细胞和T细胞激活位点的能力。组织学研究表明,咪喹莫特治疗后,T细胞和DC对肿瘤病变的浸润增加,这进一步支持了其免疫作用机制。
5.4 免疫治疗的其他方法
21.5.4.1树突状细胞疫苗
成熟的DC是高效的APC,因此是诱导T细胞反应的核心参与者。因此,使用存在TAA的DC在体内诱导抗肿瘤T细胞的过继细胞治疗是主要的兴趣(Tacken等人,2007)。通常,这些DC是通过骨髓祖细胞(用于小鼠)或外周血单核细胞(用于人类)的体外分化获得的。粒细胞-巨噬细胞集落刺激因子(GM-CSF)和IL-4通常用于刺激分化。图21-16概述了用于输注的DC的生成。用TAA装载DC的一些方法包括将源自TAA的肽装载到表面MHC分子中,用整个TAA蛋白孵育DC,以及用编码TAA的DNA转染或转导DC。负载TAA的DC也可以暴露于各种成熟刺激以增强其免疫原性。这些刺激包括激动性抗CD40抗体、各种TLR配体(如CpG寡核苷酸、poly I:C、LPS)和细胞因子混合物(如IL-1β、IL-6、TNF和前列腺素E2的混合物)。
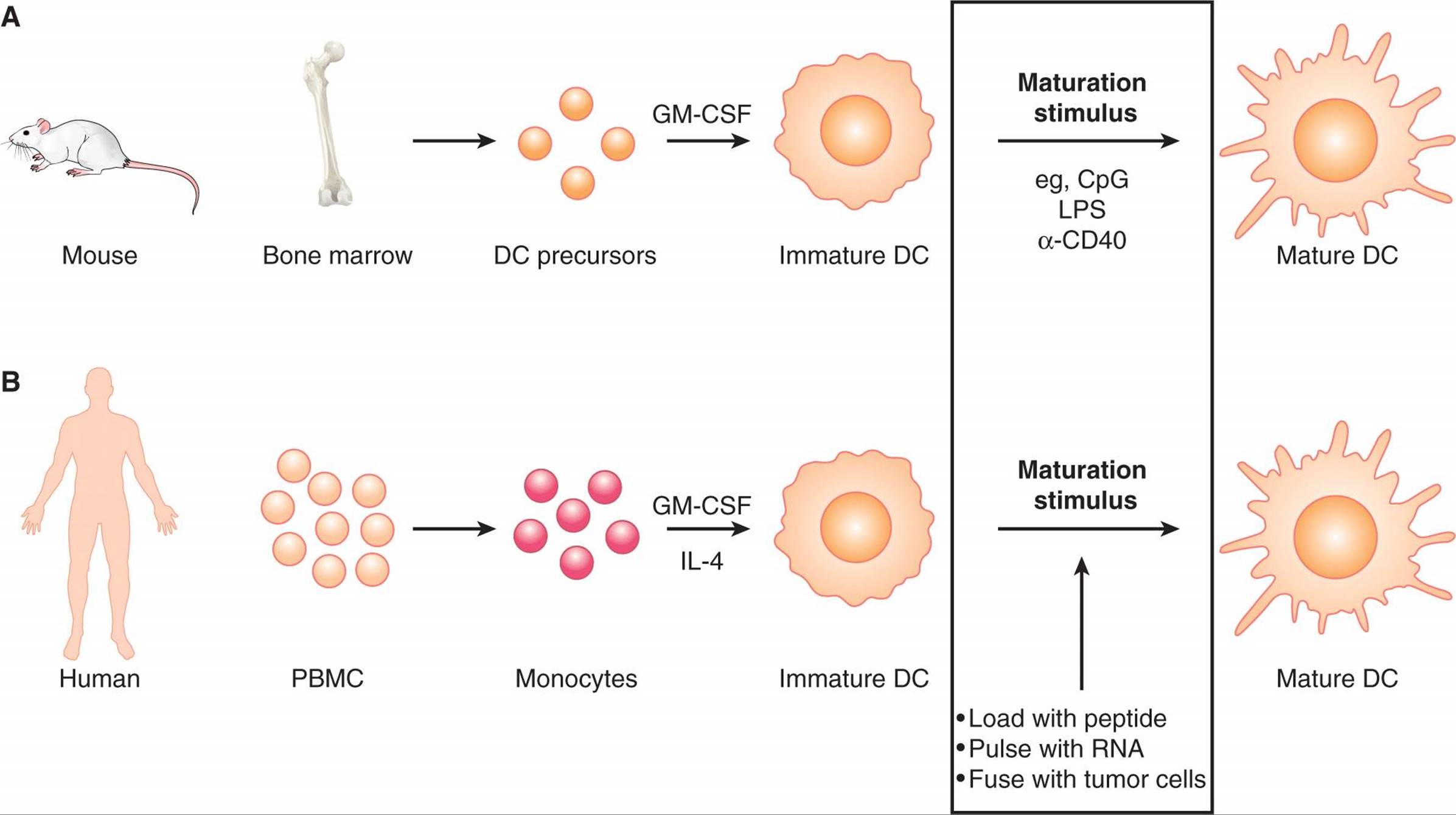
FIGURE 21–16 Generating DCs for therapy. Common methods for generating DCs for vaccination are shown. A) For mouse studies, DC precursors are obtained from bone marrow cells and differentiated into immature DCs in vitro using GM-CSF. (B) For human studies, monocytes are obtained from peripheral blood mononuclear cells by a variety of methods, including elutriation, plastic adherence, or isolation of CD14+ cells. Monocytes are then differentiated into immature DCs in vitro using GM-CSF and IL-4. For both mouse and human studies, immature DCs are manipulated to present tumor-associated antigens. This can be done by a variety of approaches, including exposing them to peptides or RNA, or fusing the DCs with tumor cells. DC maturation is induced by stimuli such as TLR ligands (eg, LPS or CpG oligodeoxynucleotides) or agonistic anti-CD40 antibody. Mature DCs presenting TAAs are then ready for infusion.
基于DC疫苗接种的临床试验表明,这种方法的毒性最小,并且有一些临床有效性的证据(Tacken等人,2007;Palucka等人,2012年)。
5.4.2 Sipuleucel-T
Sipuleucel-T是第一个获得FDA批准的癌症自体细胞疗法。该治疗产品由癌症前列腺患者的白血病生产。将白血病细胞转移到中心设施,在那里处理细胞并与前列腺TAA(前列腺酸性磷酸酶[PAP])和细胞因子GM-CSF的融合蛋白孵育(Small等人,2000)。然后将细胞产物再次注射到同一患者体内。这种治疗的前提是APC,如DC,将吸收融合蛋白。PAP将由APC表面的MHC分子处理和呈递,从而能够刺激PAP特异性T细胞介导抗肿瘤活性。GM-CSF的功能包括促进DC的分化。有效APC如DC呈递前列腺TAA应在回输时激活内源性前列腺特异性T细胞。然而,目前尚不清楚白血病治疗产品中存在的其他细胞类型如何有助于治疗的有效性。体外生物效价测试以及临床试验数据表明,该活性可归因于表达CD54的细胞部分,CD54是在包括APC在内的多种细胞类型上表达的细胞粘附分子。对2项III期试验的综合分析显示,与安慰剂相比,接受sipuleucel-T治疗的晚期前列腺癌癌症患者的生存获益(Higano等人,2009),Sipuleuceel-T组中位生存期为23.2个月,安慰剂组中位存活期为18.9个月。常见的不良事件包括寒战、发热和头痛,并且大多是低级别的。另一项双盲、多中心的III期试验显示了类似的结果。在这项试验中,512名患有转移性去势耐受性前列腺癌症的男性以2:1的比例随机接受Sipuleuceel-T或安慰剂(Kantoff等人,2010)。有趣的是,两组患者达到客观疾病进展的时间相似,但与安慰剂组相比,Sipuleucel-T组的相对死亡风险降低了22%,从而使中位生存率提高了4个月。然而,这项试验受到了批评,因为对照组患者使用了白血病切除术(但并非所有对照组患者都重新输注了白细胞),白细胞的损失可能是有害的,尤其是对老年人,(部分)由于对照组的结果较差而导致生存率差异(Huber等人,2012)。
5.4.3 CTLA-4
阻断CTLA-4在活化的T细胞和Treg细胞上表达。动物模型的初步实验表明,阻断CTLA-4可诱导肿瘤消退。已经开发出两种治疗性抗CTLA-4阻断抗体。一种是全人IgG2抗体(Tremelimumab)(Ribas,2008),另一种是完全人IgG1抗体(Ipilimumab))(Weber,2008)。这些药物主要在转移性黑色素瘤患者中进行了测试。
当最初使用客观反应(即肿瘤缩小)来评估临床反应时,这些药物的临床活性似乎相对较低。然而,这种类型的免疫调节剂可能会诱导非常规的反应模式,如消退之前的肿瘤进展,或不同病变的混合反应,但肿瘤负担总体降低(Wolchok等人,2009)。事实上,一项针对不可切除的III期或IV期黑色素瘤患者的III期随机试验表明,与未接受抗CTLA-4阻断剂的患者(6.4个月)相比,接受Ipilimumab的患者的中位总生存期(10.0个月)明显更长(Hodi等人,2010)。因为抗CTLA-4阻断不是抗原靶向方法,它与一些3级或4级自身免疫毒性有关,最常见的是结肠炎。2010年,Ipilimumab获得美国食品药品监督管理局批准用于治疗不可切除或转移性黑色素瘤患者。
尽管CTLA-4信号传导的负调控作用已经得到很好的证实,但抗CTLA-4阻断诱导抗肿瘤T细胞免疫的机制仍在研究中。抗CTLA-4阻断的主要靶点是对效应T细胞“刹车”还是抑制Tregs的抑制活性,仍存在一些争论。CTLA-4阻断被认为通过以下机制增强效应T细胞:抗CTLA-4抗体可以阻止CD80和CD86与CTLA-4的相互作用,从而允许CD80和D86与阳性共刺激受体CD28的长期相互作用。此外,CTLA-4阻断可能抑制CTLA-4介导的关闭效应T细胞的负性细胞内信号。还有强有力的证据表明,CTLA-4以非细胞自主的方式抑制效应T细胞,即通过抑制Tregs的抑制活性(Bachmann等人,1999;Read等人,2000年)。有证据表明,CTLA-4对效应T细胞和Tregs的影响有助于其增强抗肿瘤免疫反应的能力(Peggs等人,2009)。
5.4.4 过继性T细胞治疗
输注能够识别和破坏肿瘤细胞的T细胞是免疫疗法的主要关注领域。供体淋巴细胞输注(DLIs)已最终证明,转移的T细胞可以介导强大的抗肿瘤作用,这是异基因骨髓移植后复发性白血病患者的标准治疗方法。对于使用DLI的治疗,来自异基因骨髓移植供体的淋巴细胞被存储在样本库中。如果白血病患者在骨髓移植后复发,那么将来自同一供体的淋巴细胞输注到患者体内。这些淋巴细胞介导复发性白血病的消退(即所谓的移植物抗白血病效应)。对于复发性慢性粒细胞白血病患者,70%接受DLI治疗的患者病情完全缓解(Kolb等人,2004)。这种方法表明T细胞具有介导抗肿瘤活性的潜力。
过继性T细胞治疗是基于离体扩增和操作患者来源的肿瘤特异性T细胞,然后以自体方式回输。产生用于过继细胞治疗的T细胞的一般方法如图21-17所示,如下所述。
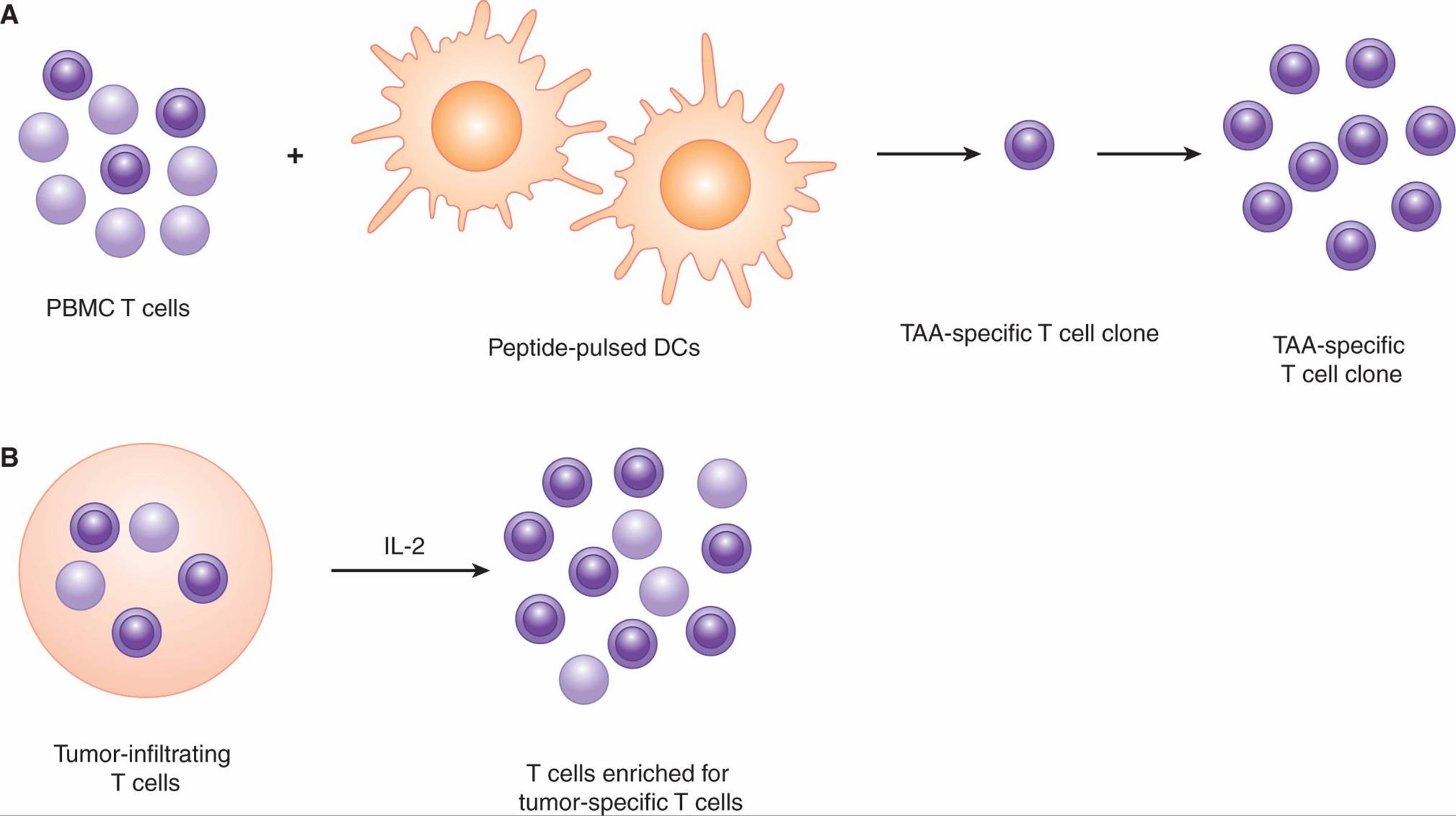
FIGURE 21–17 Generating T cell clones or tumor-infiltrating lymphocytes (TILs) for adoptive cell therapy. A) To generate T-cell clones, peripheral blood mononuclear cells are isolated and the bulk T-cell population is stimulated with DCs that have been exposed to peptides derived from tumor-associated antigens. Through successive rounds of stimulation and expansion, tumor-specific T cells are selectively expanded. These T cells are cultured under “limiting dilution” conditions to generate cultures originating from 1 parent cell (a “clone”) consisting of T cells with the same T-cell receptor. B) To generate TILs, tumor tissue is dissociated and the bulk population of TILs is expanded in vitro using a T-cell growth factor (eg, IL-2). In theory, the resulting T-cell population is enriched for tumor-specific T cells.
5.4.4.1 T细胞克隆的过继细胞治疗
过继细胞疗法的一种T细胞来源是来自癌症患者外周血的扩增T细胞克隆。这种方法的优势在于,转移的T细胞的肽特异性是明确的,并且外周血T细胞没有受到肿瘤微环境中存在的免疫抑制因子的影响,因此可能更具反应性。这种方法的潜在缺点包括这些T细胞可能不属于肿瘤部位。肿瘤细胞也有可能不表达T细胞克隆识别的肽,并逃避T细胞的检测。
产生用于治疗的T细胞克隆的一般方法包括用来源于感兴趣的TAA的肽刺激大量外周血T细胞。研究最充分的TAA衍生肽是那些结合HLA-A0201 MHC分子的肽,因此使用克隆的过继细胞治疗试验通常仅限于HLA-A020阳性患者。然后在有限稀释条件下培养肽刺激的T细胞,以扩大源自单个克隆的T细胞群。从单个T细胞扩增的所有T细胞将表达相同的TCR,因此可以被认为是克隆。CD8+T细胞克隆和最近的CD4+T细胞无性系已用于早期临床试验,这些试验已证明这种方法与低毒性有关(Yee,2010)。
5.4.4.2肿瘤浸润淋巴细胞过继细胞治疗
许多实体瘤被T细胞浸润。因为在正常情况下,T细胞不会浸润组织,肿瘤浸润性T细胞(TIL)的存在表明正在发生抗肿瘤反应,并且T细胞浸润可能富集了那些能够识别TAA的细胞。因此,TIL代表了用于治疗的肿瘤特异性T细胞的来源。TIL可以在肿瘤组织解离后获得,并且TIL的扩增可以在各种T细胞生长因子如IL-2存在下离体进行。大量TIL的过继转移已在各种癌症的试验中进行,包括黑色素瘤、癌症、肾细胞癌和非小细胞癌症。总之,这些试验表明,TIL的过继转移与最小的毒性有关,其中一些研究提供了TIL具有临床活性的证据。
在一系列特定的试验中,当转移性黑色素瘤患者接受基于TIL的方案治疗时,已经观察到高临床应答率。在这些方案中,患者在输注TIL(1010至1011个细胞)和高剂量IL-2治疗之前立即接受非清髓性淋巴消耗化疗(环磷酰胺和氟达拉滨)。使用该方案,RECIST(实体瘤反应评估标准)标准的客观临床反应率约为50%(21/43名患者)(Dudley等人,20022005)。当将全身照射添加到治疗方案中时,观察到随着淋巴耗竭强度的增加,临床反应率呈上升趋势(Dudley等人,2008)。因此,TIL转移与其他治疗干预措施的结合有可能改善疾病结果,尽管这尚未在III期试验中进行测试。
六、总结
6.1 免疫系统
-
免疫系统的两个分支是先天免疫和适应性免疫。先天免疫系统的功能之一是检测病原体的存在并将抗原呈递给适应性免疫系统的细胞。树突状细胞(DC)是一种高效的抗原呈递细胞(APC)。当DC遇到病原体时,它们会从未成熟状态分化为成熟状态。成熟的DC具有有效激活T细胞的能力。
-
抗原通过主要组织相容性复合体(MHC)分子提供给T细胞。MHC分子提供的抗原是肽片段,其可以衍生自自身或外来蛋白质。MHC分子主要有两种类型:MHC I类和MHC II类。一般来说,MHC I类分子从细胞内蛋白(“内源性途径”)呈递抗原,MHC II类分子从胞外蛋白(“外源性途径”)递交抗原。这种模式的例外是一种称为“交叉呈递”的途径,MHC I类分子可以呈递来源于外源的抗原。
-
B细胞通过B细胞受体(BCR)识别天然形式的抗原。BCR是一种膜结合形式的可溶性免疫球蛋白(抗体),在激活时由B细胞产生。T细胞将抗原识别为MHC分子通过T细胞受体(TCR)呈递的肽片段。TCR在T细胞表面表达,不分泌。BCR和TCR特异性的多样性部分是一种称为V(D)J重排的DNA重排过程的结果。在这个过程中,从大量可能的基因片段中选择的基因片段被剪接成组合的外显子。
-
当TCR与其同源肽/MHC配体结合时,会诱导T细胞反应。生产性T细胞激活还需要通过共刺激分子(如CD28)发出信号。T细胞活化导致T细胞的增殖以及获得效应器功能。T细胞激活后,大多数被激活的T细胞消失,只留下一小部分记忆T细胞。T细胞反应受到各种机制的抑制,包括通过细胞毒性T淋巴细胞抗原(CTLA)-4和程序性死亡(PD)-1等分子的下调。
-
有各种类型的T细胞。细胞毒性T淋巴细胞(CTL)可以杀死靶细胞,通常表达CD8共受体并识别MHC I类分子呈递的肽。Th细胞根据其特定的Th细胞亚型(Th1、Th2、Th17等)分泌各种细胞因子。lper细胞表达CD4共受体并识别MHC II类分子呈递的肽。
-
各种机制有助于建立T细胞对自身抗原的耐受性。例如,在胸腺中的T细胞发育过程中,强烈识别自身抗原的T细胞被清除。逃避胸腺发育的自身反应性T细胞可以被各种外周耐受机制抑制,包括调节性T细胞(Tregs)。
6.2 瘤免疫学与免疫治疗
-
肿瘤相关抗原(TAAs)是肿瘤细胞优先(或唯一)表达的蛋白质。TAA的类型包括突变的自身蛋白、癌症评估抗原、分化过程中正常表达的蛋白、过表达的自身蛋白和病毒抗原。它们也可能具有独特的翻译后修饰。一些TAA衍生的肽可以被T细胞识别。肽/MHC多聚体试剂可以帮助检测TAA特异性T细胞。
-
免疫系统可以调查身体中的肿瘤细胞并消除它们,这一概念被称为“癌症免疫监测”。免疫监测在研究中得到了部分证明,免疫缺陷小鼠比免疫活性小鼠发生肿瘤的频率更高,动力学更快。目前肿瘤进展和与免疫系统关系的模型包括三个阶段:消除、平衡和逃逸。免疫系统在控制肿瘤生长方面的重要性在一定程度上得到了研究的证明,这些研究表明肿瘤中T细胞浸润与良好预后之间存在相关性。
-
抑制T细胞对肿瘤反应的屏障包括也抑制T细胞对抗自身抗原反应的耐受机制。此外,肿瘤微环境中可能存在免疫抑制因子,如转化生长因子(TGF)-β和吲哚胺2,3-双加氧酶(IDO)。
-
单克隆抗体(mAb)与其靶蛋白特异性结合。mAb生产的经典方法涉及杂交瘤的产生。单克隆抗体可以完全来源于动物(如小鼠),也可以是嵌合的、人源化的或全人类的。单克隆抗体治疗具有多种可能的作用机制:阻断受体信号传导、触发受体信号传导,激活补体级联反应导致靶细胞裂解,或通过抗体依赖性细胞介导的细胞毒性进行靶细胞裂解。此外,mAb治疗可能由于抗原的摄取和呈递增强而增强T细胞启动。
-
经批准的癌症免疫疗法包括用于治疗浅表性膀胱癌症的Calmette-Guerin芽孢杆菌、用于某些血液系统癌症的干扰素-α、用于肾细胞癌和黑色素瘤的白细胞介素-2、用于浅表性基底细胞癌的咪喹莫特和用于转移性黑色素瘤(阻断T细胞反应负调控的阿莫克隆抗体)。这些是以多克隆方式增强T细胞反应的“非特异性”方法。
-
其他免疫治疗方法正处于不同的发展阶段。DC疫苗接种涉及自体DC的体外生产。通常,这些DC负载TAA衍生的肽,并在给药前在各种刺激下成熟。第一个获得FDA批准的癌症自体细胞疗法是Sipuleucel-T治疗癌症。正在研究的其他类型的过继细胞疗法包括用肿瘤特异性T细胞克隆或用肿瘤浸润淋巴细胞的免疫疗法。
参考资料
