【2.4.4.2】orthoMab
可以通过共表达两个亲本单克隆抗体来组装IgG BsAb。然而,共表达两条重链和两条轻链以产生IgG BsAb通常会导致一些组装错误和副产物。例如,来自同一亲本mAb的两条重链可以彼此配对(形成重链同二聚体),而不是与另一对亲本mAb的重链配对。另外,一个亲本mAb的重链可能会与另一个亲本mAb的轻链组装在一起(图1a)
以防止形成重链同源二聚体的,人们可以工程师一个CH3结构域促进重链异二聚化。实际上,大约20年前就已经描述了解决CH3同二聚/异二聚问题的第一种方法,之后是其他已审查的解决方案。
由于抗体Fab中复杂的多域异二聚体相互作用,解决轻链错配问题更加困难。
- 一种解决方案是使用单个轻链产生IgG BsAb。但是,这需要轻链工程或利用单个轻链的新型抗体文库,从而消除了很多多样性。
- 另一种方法是设计一个正交的(orthogonal )重链-轻链界面,该界面允许每个轻链以比非同源重链更高的亲和力与其同源重链结合。例如,可以将一条重链的CH1结构域与C L交换其同源轻链的域。然而,我们发现V H -V L相互作用可以控制重链和轻链之间的相互作用特异性。这可能会使通过重链和轻链之间交换恒定域而赋予的任何配对特异性复杂化或超越。
由于这些原因,设计完全正交的重链-轻链界面可能是获得所需的重链-轻链特异性的更可靠的解决方案。在这里,我们使用分子建模,X射线晶体学反馈和人工指导设计来描述正交IgG重链-轻链界面的设计。
一、Design of an orthogonal CH1-CL interface
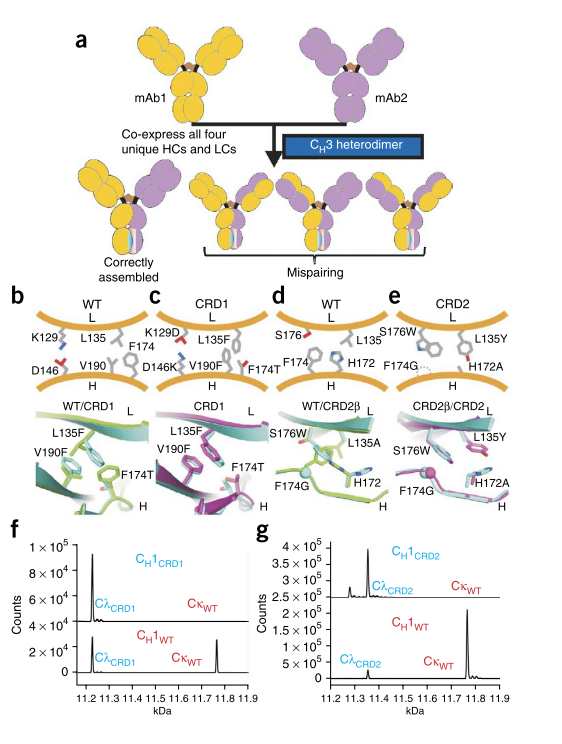

我们将最初的精力集中在重新设计CH1-CL interface 上。为了生成不利于与野生型(WT)C H 1-C L结合的突变C H 1-C L interface ,我们在建模程序Rosetta 中使用了多状态设计应用程序。在多态设计中,通过建立靶标和脱靶复合物的模型,预测两种复合物的结合能,并寻找可增加靶标与脱靶相互作用之间的能隙,同时保持稳定性的突变,来评估候选靶复合物序列。通过针对界面的不同区域中的残基簇进行独立的模拟,我们确定了20个设计范例,这些范例有望比突变WT对更支持突变-突变配对(补充表1)。我们使用“设计范式”( ‘design paradigm’)来指一组高度相似且被预测为等能量的序列。从20个设计范例中,构建并筛选了40多个特定序列。
实验评估C H 1-C L设计的特征需要生成缺少可变域的IgG1构建体,称为IgG1(–Fv)(补充图1)。如SDS-PAGE分析所揭示,IgG1(–Fv)的组成蛋白正确组装,并且该复合物以95 kDa的分子量单分散,如尺寸排阻色谱法(SEC)和在线静态光散射显示( SLS);如差示扫描量热法(DSC,differential scanning calorimetry)测量所示,它是高度稳定的(补充图1)。
在人类胚胎肾脏(HEK)293F细胞中瞬时转染后,来自十个设计范例的序列以与WT IgG1(–Fv)相似的水平表达(补充表1)。通常,表达良好的设计蛋白质突变较少,而所有具有9个以上突变的蛋白质均不表达。 稳定表达的突变蛋白被进一步转染为WT重链或轻链错配的重链-轻链对。来自三个设计范例的突变蛋白具有突变-突变对,其比错配的突变-WT对更稳定。这些范例中的每个范例最多包含三个突变。
两种不同的设计C L _L135F / C H 1_V190F_F174T和C L _K129D / C H 1_D146K(有关序列上下文,请参见补充图2)彼此之间略微正交,因此我们将突变组合成一个单一的组合设计,称为恒定重新设计1(CRD1,constant redesign 1)。CRD1 C H1 -Cλ对的表达水平是WT的50%,其热解折叠温度接近WT对(数据未显示)。我们解决了WT C H1 -Cλ异二聚体(PDB:4LLD,1.19Å)和CRD1 C H1 -Cλ异二聚体(PDB:4LLM,1.75Å )的高分辨率晶体结构(图1b,c)。CRD1异二聚体的晶体结构与基于Rosetta的模型非常匹配,在CRD1的三个核心重排残基中,所有非氢原子的偏差均为1.07 rms(图1c)。 铁汉 14:19:21 第三个设计表示CRD2β(C大号_L135A_S176W / C ħ 1_F174G)也表现出有前途的特异性和稳定性。匹配的CRD2β重链–CRD2β轻链对比错配的对(WT轻链–CRD2β重链和CRD2β轻链– WT重链)表达更好,更稳定。CRD2β被设计为在WT界面内部引入严重的空间碰撞,并带有残留物(图1d)。但是CRD2β(PDB:4LLQ,1.42Å)的晶体结构显示C H 1_F174G和C H之间存在脯氨酰反式-顺式肽键异构化1_P175允许在Cλ_176处引入的色氨酸相对于模型翻转方向(补充图3c)。我们将设计和晶体结构之间的不匹配解释为色氨酸未充分包装。
然后,我们以CRD2β结构为起点,进行了第二轮多状态模拟,以更紧密地压缩Cλ_W176周围的区域,同时进一步转向WT结构。在筛选了八种新设计后,我们发现最稳定,表达最强的设计包括C L _L135Y S176W / C H 1_H172A F174G(补充图2),表示为CRD2。带有CRD2的IgG(–Fv)蛋白的表达略好于WT,其错配对的表达较差,并且是组装蛋白和未组装蛋白的混合物(补充图3f)。在热激发试验中,CRD2的表观稳定性与WT相似,并且它的错配对更不稳定(补充图3h)。)。
CRD2的晶体结构显示主链和侧链结构回复到接近原始CRD2β设计模型(PDB:4LLY,1.60Å)的构象。晶体结构(图1e)显示了C H 1突变F174G和H172A如何为小到大的C L突变S176W和L135Y腾出空间。CRD2β模型和CRD2晶体结构的重叠图表明W176现在采用了CRD2β模型中预测的旋转异构体,并且残基174和175之间的肽键处于天然反式构象,而突变后Fab结构几乎没有变化区域(图1e和补充图4)。
接下来,我们进行了一项竞争实验,其中两个C L(一个WT和一个突变体)与带有WT或突变体C H 1的一条IgG(–Fv)重链共表达。质谱(MS)用于确定匹配的CL是否优于IgG(–Fv)重链缔合和分泌的错配CL。Cλ CRD1 outcompetedCκ WT和Cλ WT结合于IgG(-Fv)具有c ħ 1 CRD1(补充表2和图1F)。然而,Cλ WT和Cκ WT结合至大致相同的程度,Cλ CRD1对含有C H 1 WT的IgG(–Fv)进行了检测。Cλ CRD2 outcompeted两个Cκ WT和Cλ WT对结合的IgG(-Fv)具有c ħ 1 CRD2(100%),和Cκ WT和Cλ WT很大程度上outcompetedCλ CRD2结合于IgG(-Fv)重链具有c ħ 1 WT(分别为95%和93%;补充表2和图1g)。基于这些实验,CRD2在表达,稳定性和特异性方面均优于CDR1。
CRD1和CRD2以IgG(–Fv)格式提供的特异性并未转化为包含Pertuzumab(Perjeta;乳腺癌药物)V H和V L的IgG格式。当使用含有WT和CRD1或CRD2 C H 1-C L结构域的全长轻链和重链进行上述针对IgG(-Fv)的相同竞争实验时,未观察到配对特异性(补充表2)。这种特异性丧失是出乎意料的,因为C H1 -Cλ与78°C的高T m协同展开,而类似scFv-Fc形式的帕妥珠单抗V H和V L与T非协同展开m分别为55°C和70°C(补充图1d)。因此,我们将努力转向在V H -V L interface 内设计其他配对特异性。
一顿操作猛如虎,结果没啥效果,所以要转向VH-VL。。。。。
二、正交V H -V L接口的设计 Design of an orthogonal VH-VL interface
V H -V L界面重新设计的主要目标是
- 尽可能地修饰保守残基,以使该解决方案适用于多个V H -V L种系片段,以及
- 最小化对抗原结合的影响。
首先,我们在合理的高度保守的V引入带电荷残基大号_Q38-V ħ在所述Fv的“底部” _Q39氢键对,远离的互补决定区(CDR)中除去。电荷对引入的scFv和双抗体在这些位置上没有先前显着改变的Fv稳定性。在所有可能的电荷配对变体中,VL_Q38D-V ħ _Q39K对被最-容纳孔中培妥珠单抗的Fab内,根据它的表达水平(数据未显示)。接下来,我们反转了保守的V L _D1的电荷,并在V H中添加了一个带负电荷的残基,以促进其他特异性。表达最充分的电荷反转是V L _D1R和V H _R62E(数据未显示)。编码两个电荷对的分子(V L _Q38D-V H _Q39K / V L _D1R-V H _R62E)表示为VRD1(补充图2)。WT Fab的晶体结构(PDB:4LLU,2.16Å)和包含VRD1的Fab(PDB:4LLY,1.60Å)表明,突变区域之外的结构区域不受干扰(图2a,b和补充图4)。
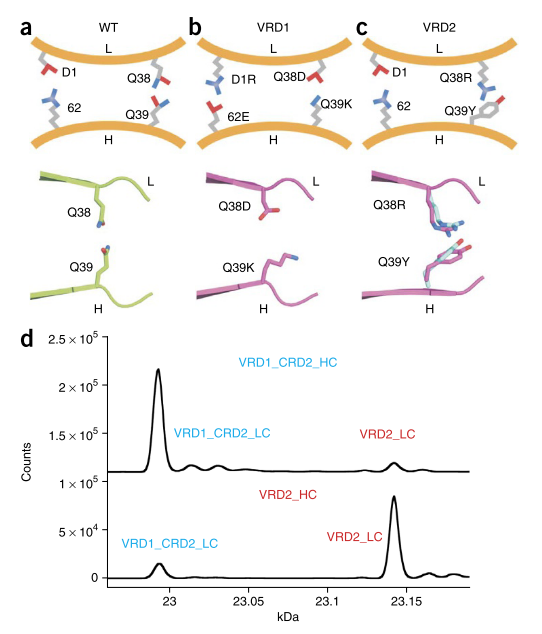

用于生成其他V H -V L接口设计的多状态设计巧合地暗示了在同一V L _Q38-V H _Q39残基对处的其他突变(补充表1)。表达和稳定性的筛选确定了V L _Q38R-V H _Q39Y,表示为VRD2(补充图2),是改善重链-轻链特异性的强力候选者(图2c)。VRD2的晶体结构表明,R38和Y39形成了阳离子-π相互作用,在突变区域外,WT Fab的变化很小(图2c和补充图4; PDB:4LLW(1.95Å)。
接下来,我们通过轻链竞争来筛选与特定重链结合的可变域设计。所有重链和轻链,两者设计和WT,帕妥珠单抗含有V ħ和V大号分别。首先,我们将WT轻链和一条重链一起表达VRD1或VRD2轻链。相对于WT轻链,VRD1和VRD2均更有效地与其同源突变重链结合,而与WT重链的结合效率较低。但是,在某些情况下,正交程度不高(补充表2)。当VRD1和VRD2轻链相互竞争(而不是与WT轻链)竞争结合VRD1重链或VRD2重链时,正交性得到了提高(补充表2)。
接下来,我们测试了将VRD1和VRD2与CRD2结合使用的影响。在竞争测定中,将CRD2添加到VRD1或VRD2分别提高了VRD1轻链和VRD2轻链分别与VRD1或VRD2重链结合的特异性。但是,VRD1_CRD2轻链和VRD2_CRD2轻链仍然与WT重链相对频繁地配对(补充表2)。因此,我们针对VRD2轻链测试了VRD1_CRD2轻链与VRD1_CRD2重链或VRD2重链的结合。在这种情况下,我们分别观察到87%和91%的特异性(图2d和补充表2)。我们假设V H _VRD1突变体Q39K与V L强烈冲突_VRD2突变体Q38R,导致与涉及WT链的组合相比,特异性显着提高。
我们通过在HEK293F细胞中瞬时表达产生了包含VRD1_CRD2或VRD2的IgG1蛋白,并使用一步蛋白A柱纯化了它们。如SEC-SLS所示,VRD1_CRD2和VRD2 IgG均为单体(补充图5a)。IgG的Fab T m s分别为71°C和73°C,与WT pertuzumab Fab T m(77°C)相当,并且高于衍生自scFv的第一个解折叠事件(T m = 55°C)。来自pertuzumab(补充图5b)。而且,设计的Fab的HER2抗原结合动力学与WT帕妥珠单抗Fab的HER2抗原结合动力学相同(补充图5c)。
我们的方法要求将多个突变引入可变域和恒定域的保守框架区。因此,它有可能在人类中产生新的B细胞和T细胞表位以及不希望的抗药物抗体反应。使用EpiVax服务器对T细胞表位的初步预测表明免疫原性没有增加(补充表3)。但是,将需要对治疗性候选分子进行进一步研究以充分评估该问题。
三、方法
- 在Rosetta的InterfaceAnalyzer模块的帮助下,选择适合于C H 1-C L接口突变的残基。
- 下列固定骨架序列优化,我们重新评价用redocking协议的每个设计,允许两条链之间的刚性体运动
- 使用基于Rosetta的蛋白质模拟器FoldIt的专家模式通过人工检查选择了一些设计(补充表1,范例5和6),并使用相同的对接分析进行了确认
参考资料
- Nature Biotechnology volume 32, pages191–198(2014). Generation of bispecific IgG antibodies by structure-based design of an orthogonal Fab interface. https://www.nature.com/articles/nbt.2797
