【1.7.4.2】CD47(integrin-associated protein, IAP)
一、CD47靶点介绍
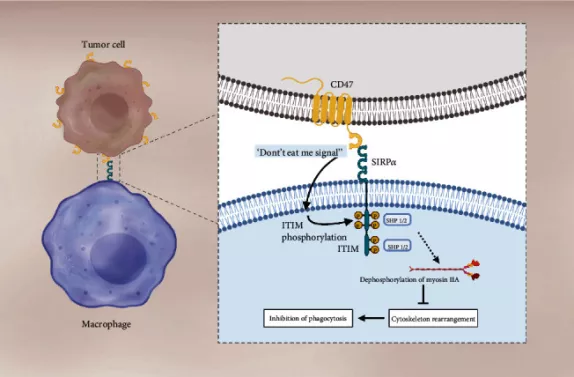
CD47又称为整合素相关蛋白(integrin-associated protein, IAP),属于免疫球蛋白超家族,是一个拥有5个跨膜域的跨膜糖蛋白,广泛表达于几乎所有的正常细胞表面。目前已知的CD47的天然配体有三种:
- 整合素(integrin)
- 血小板反应蛋白-1(Thrombospondin-1,TSP-1)
- 信号调节蛋白α(Signal-regulatory proteinα,Sirpα)。
CD47与其配体主要参与细胞黏附、细胞迁移、吞噬功能,以及维持机体免疫稳态。
其中,Sirpα的表达局限于巨噬细胞、树突状细胞以及神经细胞表面。在免疫反应中,CD47主要通过与巨噬细胞表面的Sirpα结合,释放一个“别吃我”信号,从而保证正常细胞不被巨噬细胞“吃掉”。在这里,CD47扮演了一个“自我(self)”细胞的标记,而一些肿瘤细胞也会利用CD47/Sirpα信号通路,高表达CD47以实现免疫逃逸。
二、CD47靶点抑制剂的作用机制
针对CD47-SIRPα信号通路的疗法有多种作用机制,主要包括:
- 阻断CD47与SIRPα的结合,瓦解“别吃我”信号,促进吞噬细胞吞噬肿瘤细胞;
- CD47抗体可通过促进DC细胞对肿瘤细胞的吞噬作用,随后将抗原呈递给T细胞,刺激抗肿瘤适应性应答;
- CD47抗体通过NK细胞介导的ADCC和CDC作用杀伤肿瘤细胞;
- CD47抗体可激活肿瘤细胞凋亡途径,直接诱导肿瘤细胞凋亡。
三、CD47靶点适应症
CD47抗体可针对多种适应症,目前临床试验针对该靶点的适应症包括非霍奇金淋巴瘤(NHL)、急性髓性白血病(AML)等血液系统恶性肿瘤,以及结肠直肠癌、卵巢癌、乳腺癌、膀胱癌和头颈癌等实体瘤。从目前数据来看,CD47靶点在高风险骨髓增生异常综合征表现出优异响应,但在非霍奇金淋巴瘤初步响应并不高,实体瘤(如非小、胃癌、头颈癌)早期响应不理想,头颈癌和胃癌早期响应在20%左右。头颈癌适应症,ALX148联合帕博利珠单抗,总体响应20%;胃癌适应症,ALX148联合曲妥珠单抗,总体响应21%。
四、CD47全球在研管线
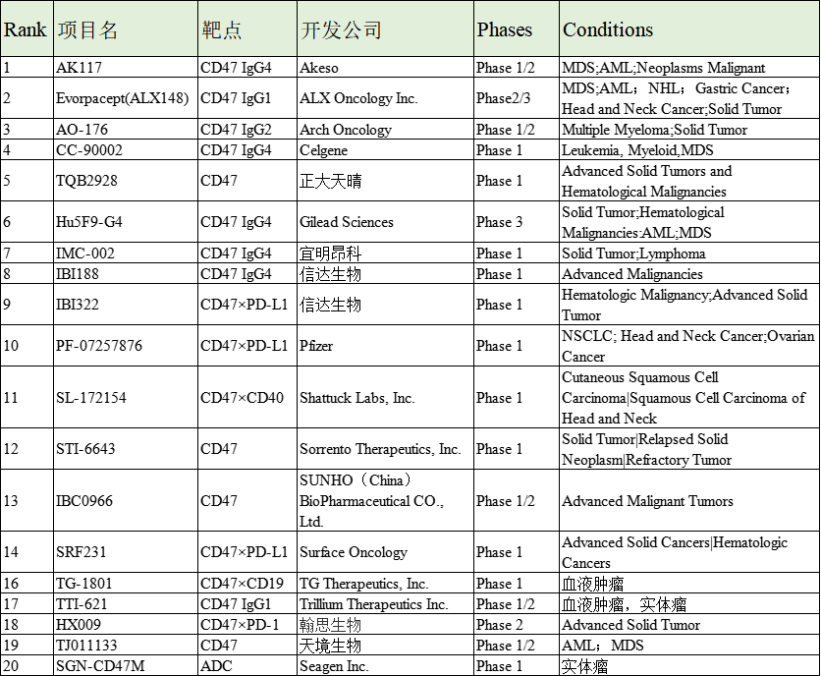
CD47抗体疗法主要分为三个研究方向:单药、联用治疗性抗体药物以及联用T细胞检查点抑制剂。目前,全球超过30家公司正在开发针对CD47靶点的药物,具体涉及单抗、双抗、融合蛋白和小分子三类,其中有近20款已迈入临床研究阶段,暂无该靶点药物上市,最高开发阶段为临床III期。国外有Forty Seven、Celgene、Trillium、ALXOncology等,而国内除了天境生物,目前也有不少药企拿到了临床批件,如信达生物、恒瑞医药、宜明昂科、再鼎医药等等。
图表. 全球CD47在研管线(资料来源:clinical trials)
五、CD47抗体开发的挑战
-
红细胞毒性:由于正常细胞(包括红细胞、T淋巴细胞等)也表达CD47,因此需要特别注意所开发的抗体是否会对正常细胞带来不利影响。如果抗体与红细胞结合,则可以通过两种途径引起红细胞破坏:一是通过抗体与不同红细胞结合而造成红细胞凝集,进而引起红细胞裂解;二是通过Fc介导的效应功能(ADCC/ADCP)引起NK/Mf细胞攻击红细胞。因此,如何避免与红细胞结合就成了CD47抗体药物开发的首要关注点。
-
T淋巴细胞毒性:如果CD47抗体与T淋巴细胞CD47的某个表位结合,就有可能引起T细胞凋亡,如果开发的抗体药碰巧引起了T淋巴细胞凋亡,那么临床开发就不可能成功。
-
IgG亚类的选择:CD47这个免疫检查点对应的免疫细胞是巨噬细胞,而激活这类细胞依赖于Fc-FcgR相互作用,仅仅阻断CD47-SIRPα相互作用是不足以激活巨噬细胞的,从这方面考虑,CD47抗体应该选择IgG1才能够激活巨噬细胞。然而由于CD47抗体多半能与红细胞结合(即使经过大量筛选,也很难排除与红细胞的结合,只能筛选结合相对较弱的抗体),如果选择IgG1,则会激活免疫细胞(Mf, NK)对红细胞进行攻击,所以为了避免由此而产生的红细胞毒性,只能选择IgG4,这样一来,抗肿瘤活性就大打折扣,单独用药的疗效十分有限,必须与其它具有ADCC/ADCP活性的抗体药联用才能达到预期效果。到目前为止,所有开发CD47抗体的公司,都选择了IgG4。
-
临床前动物模型:在评估早期CD47项目时,动物模型的选取非常关键。数据显示人类CD47和SirpαNOD模型SIRPα的结合亲和力是和人SIRPα结合的约10倍,因此数据很难复制到人体临床试验。并且SirpαNOD是免疫缺陷小鼠,无法还原诸如ADCC等重要机制。理想的异种移植模型应该是SIRPα对CD47的亲和力低于NOD,但高于C57BL/6,BALB/c可能是这样的候选者。
参考资料
