【2.5.3】ADA实验数据可靠么
与通常不会产生免疫原性的常规化学药物不同,生物制剂治疗后抗药物抗体的发展引起了人们对其抗药性对临床安全性和功效的影响的担忧。因此,阐明生物制剂的免疫原性是获得全球卫生监管机构批准药物的必要条件。在同类产品和不同患者群体之间,已发布的ADA“发病率”可能会有很大差异。这种差异是由于不同的生物分析方法和解释方法,以及许多尚未完全了解的针对产品和患者的因素所致。因此,ADA的发生率及其与临床后果的关系无法在所有产品中一概而论。在这种情况下,本文的目的是讨论ADA的复杂性以及用于免疫原性评估的方法的细微差别,并消除一些谬论和神话。
一、介绍
为了治疗自身免疫,血液学,肿瘤学,神经病学,代谢和其他疾病,越来越多地开出生物药物(也称为生物药物或生物制品,also called biological drugs or biologicals)的处方。 这些药物主要是蛋白质(单克隆抗体,细胞因子,生长因子/激素,酶和融合蛋白)和对某些已知可调节疾病机制的靶标具有特异性的肽。 尽管大多数生物制剂在总体上为整个患者群体提供了有利的利益-风险特征,尤其是对于常规和(化学,“小分子”)药物通常不足的重症和慢性适应症的治疗,这是维持临床反应的主要障碍 具有生物学特性的免疫原性的发展。
免疫原性是指免疫系统在生物产品中感知到“外来/非自我” 或“危险信号/受压自我” 并对其发起特定的免疫反应时发生的。通过检测与药物特异性结合并中和,从体内消除它或两者的抗药物抗体(ADA)的存在,来评估药物特异性免疫反应的发展。大多数生物制剂具有免疫原性,ADA的发生率可达到90%。 尽管通常在临床上发现ADA是良性的,但一部分ADA阳性患者可能对安全性和疗效产生不利影响。重要的是,同一类产品和不同患者人群之间ADA的发病率可能会有很大差异,从而阻碍了对免疫原性的预测,并需要进行临床测试。这种差异可能反映了不同的生物分析方法和解释方法,以及许多产品和患者特有的因素,而这些因素尚未完全被所理解。这进一步加剧了该问题,这是术语缺乏标准化以及用于收集,分析和呈现免疫原性结果的方法,直到最近才尝试实现全球统一。在用外源蛋白治疗患者的早期,例如牛或猪胰岛素的纯化制剂中, ADAs的发展是普遍的,并且有望在未来出现。随后,当在临床中使用鼠单克隆抗体(mAb)时,人们预期并通常会观察到人类抗小鼠抗体(HAMA)。尽管大多数生物技术衍生的治疗剂来源于重组人蛋白质文库,免疫原性继续发生,这证实了除“非人性”以外的多种因素影响免疫原性。
与通常不产生免疫原性的常规(化学“小分子”)药物不同,由于生物制剂的治疗,ADA的发展引起了人们对其安全性和功效影响的担忧。 ADA的临床后果可能从无症状到药物的有限疗效,再到更具破坏性的疾病,例如过敏反应和特定的抗体介导的免疫缺陷疾病。因此,广泛使用生物学方面,包括ADA测试在内的治疗药物监测已在临床环境中成为现实。与与小分子药物的监测方法(仅限于参考样品中药物的测量)相反,该药物和ADA通常都经过生物学评估。。这种方法上的差异也适用于药物开发过程,据此,需要阐明生物制剂的免疫原性,才能获得全球卫生监管机构的药物批准。
已发布的任何生物的ADA“发病率”取决于用于检测,确认和表征ADA的实验室方法的相对优势和警告。 因此,ADA的发生率及其与临床后果的关系无法在所有产品中一概而论。 在这种情况下,本文的目的是讨论ADA的复杂性以及用于免疫原性评估的方法的细微差别,并消除一些谬论和神话。 在为患者选择治疗方法时,医生可以考虑这些临床和药理因素,而不仅仅是药物标签或其他出版物中报道的ADA发生率。
二、ADA的性质使测量变得复杂 THE NATURE OF ADA COMPLICATES THEIR MEASUREMENT
生物物质本身是通过定义的过程制造的独特分子,并且包含用于治疗药物监测(或药代动力学)方法的单一蛋白质分析物,而ADA代表非常复杂的一组分析物。 请注意,ADA中使用的是“分析物”(analytes)而不是“分析物”(analyte),因为它们通常是多克隆的,可能包含不同的同种型[免疫球蛋白(Ig)G,IgA,IgM或IgE],结合到不同的区域(“结构域” 药物分子的亲和力(结合强度)不同,并且患者之间可能有所不同。 因此,评估ADA的实验室方法应该是:
- 能够选择性地检测针对药物分子上众多表位(抗体可以结合的抗原位点)形成的所有同种型抗体
- 足够灵敏 用于检测低亲和力和高亲和力的抗体。
ADA测试方法不是定量的(既不是确定性的也不是相对定量的);使用校正剂(calibrator )ADA(动物或人类来源)来定量ADA是不合适的,因为无法建立代表所有受试者中ADA的ADA标准制备方法。ADA方法应定性执行,因为缺乏样品与校准物之间或不同样品之间的相似性(平行度),在使用校准物测定时(从标准曲线上插补ADA浓度值)可能导致分析结果不准确。相反,建议对样品进行滴定估计ADA浓度,因此样品之间滴定度值的四倍变化可以认为是ADA水平的真正差异。但是,一些商业实验室在实验室开发的测试中使用专有试剂应用ADA校准曲线,并且风险报告有偏差ADA的“浓度”结果不准确。由于此类测试不受美国食品药品监督管理局(FDA)或欧洲药品管理局(EMA)的监管,因此建议医生在临床实践中使用测试结果之前,应了解分析的形式及其注意事项。将商业化验方法与制药商的原始方法进行交叉验证,可能会为原始方法的结果提供某些保证和解释结果的参考。
三、中和、非中和抗体在临床上均相关 NEUTRALIZING AND NON‐NEUTRALIZING ANTIBODIES ARE BOTH CLINICALLY RELEVANT
中和抗体(NAb,Neutralizing antibodies)是结合ADA的子集,可与药物结合并通过防止靶标结合,抑制其药理功能。因此,非中和抗体(non-NAb)是与药物分子上能结合的位点结合的ADA不影响靶标结合,因此不影响药物的药效学活性。非NAb通常被称为“结合抗体”(‘binding antibodies’),但这是一个不正确的术语,因为所有ADA(包括NAb)都是天生的结合抗体(因为它们结合药物)。一旦筛选测试方法检测到ADA(“结合” ADA),则对确定其中和能力非常有用,特别是对于半衰期短(几分钟到几天)或具有相同内源性对应物的药物。
服药后,NAbs可以抑制药物活性,但是非NAbs不能抑制药物的药效学活性。但是,后者可以通过增加药物清除率来降低药物的全身暴露,从而在临床上获得与Nabs相似的结果-降低了临床疗效。两种类型的ADA均可在结合药物后形成免疫复合物,并被网状内皮系统清除,导致在26天之内被完全清除。对于半衰期长的生物(例如人mAb药物),这只是一个谬误NAbs具有临床意义;由于抗原抗体复合物的清除相对较快,因此NAb和非NAb都可能对功效产生相似的影响。对于半衰期相对较短的生物,即使在清除前它们在免疫复合物中循环,NAb也会阻碍功效。。此外,据报道,稀有药物维持性ADA不能中和,但可以显着延长药物的生物学半衰期,直至人类IgG的半衰期。通过延缓活性激动剂治疗剂的清除,这种维持药物的ADA可以产生的临床效果,与ADA所产生的中和或加速清除生物的效果截然不同。
四、每种ADA实验室方法都是唯一的 EVERY ADA LABORATORY METHOD IS UNIQUE
几种实验室测定平台已用于ADA检测。直到1990年代中期,免疫原性方法一直使用放射免疫分析(RIA)技术。这种方法足以用于ADA检测,但耗时且有害,如果相关的放射性化学物质处理不当。此后,开发出具有相似或更高灵敏度(检测限较低)的更安全,更高通量的免疫测定技术,导致人们偏爱使用酶联免疫吸附测定(ELISA)和电化学发光免疫测定(ECLIA)方法。还使用了其他技术,例如表面等离子体共振(SPR)和生物层干涉术(BLI)。 SPR和BLI在检测低亲和力ADA方面表现出色。但是,与ELISA和ECLIA方法相比,它们通常具有较低的灵敏度(因此容易报告免疫原性的发生率)和较低的通量。基于高压液相色谱(HPLC)的方法通量也较低,很少使用。
免疫测定方法通常采用“直接”或“桥接”免疫测定形式。在直接免疫测定中,药物分子主要通过生物素连接子附着在板的塑料表面上(图(图1a)1a),其次附着在链霉亲和素包被的塑料表面上(图1b)。如此锚定,当暴露于测试样品时,药物分子可以捕获ADA。然后,通过与“检测分子”(一种与人抗体特异性反应的酶结合抗体)结合,检测捕获的ADA,形成分子连接复合体。为了提高信号检测的特异性,免疫分析板在检测步骤之间用化学缓冲液洗涤,该缓冲液可消除非特异性粘性抗体。最后,添加化学底物(适用于酶)会产生与测试样品中ADA量成比例的彩色,荧光或发光信号。同样,使用酶结合药物作为检测分子的架桥免疫测定法也会导致分子复合物的形成,该复合物涉及塑料表面包被的药物(图1c)或通过生物素连接剂包被的药物(图1d)。桥接测定形式可设计为均相方法,其中捕获和检测试剂可同时与样品基质结合使用,从而省去了洗涤步骤,从而改善了对低亲和力ADA或快速脱胶的ADA的检测。备选地,桥接测定方法可以在捕获和检测步骤之间并入洗涤步骤,以提高测定特异性并减少背景信号(异质形式)。均质或异质方法形式的选择在很大程度上取决于所需的测定和试剂性能特征。桥接测定形式依赖于抗体相同的双重结合位点,以在捕获和检测药物分子之间产生分子桥。在直接和桥接免疫分析形式中,信号大于或等于定义的方法切点的测试样品被归类为“ ADA阳性”。然后通过滴定度评估ADA浓度,方法是通过测试ADA阳性样品的系列稀释液并确定仍在测定中产生阳性信号的样品的最高稀释度来评估。
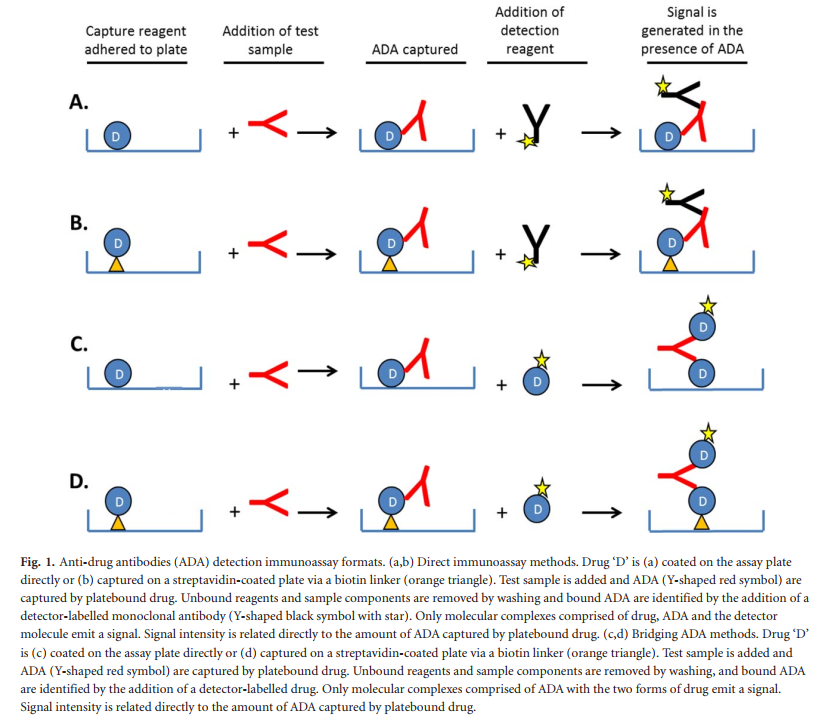
使用同种型特异性酶偶联检测器抗体的直接免疫测定法的用途可能有限,因为并非可以同时检测到所有循环的人类抗体同种型(IgG,IgM,IgA,IgE)。通常,此类方法旨在单独检测IgG,而外周血中的其他同种型-IgM和IgE-也可能对抗药物免疫原性具有重要意义。由于早期或间歇性免疫应答(例如针对某些药物的聚乙二醇(PEG)域或糖蛋白药物的碳水化合物链的免疫应答)通常包含IgM或IgE,因此研究这些类型的ADA至关重要。尽管直接免疫测定法和基于ImmunoCAP的方法已专门用于检测IgE,但是桥接免疫测定法通常更适合用于ADA检测,因为它具有出色的测定灵敏度,并且可以检测所有同种型抗体,因为该药物分子可用于ADA捕获和检测。
与亲和力较低的ADA相比,与亲和力较高的ADA在免疫分析中结合更紧密的分子在洗涤步骤中不易从分子复合物中意外释放。实际上,洗涤步骤的数量越多,在检测之前可以将更多的抗体洗掉。ELISA和ECLIA平台通常为检测较高亲和力的ADA提供足够的灵敏度,而对于较低亲和力的ADA没有提供足够的灵敏度。由于ELISA平台通常涉及更多的洗涤周期,因此与ECLIA平台相比,它们通常更容易受到此限制。
不管使用哪种技术,方法开发的一般限制是在方法开发过程中通常不会使用人ADA(或者由于可用数量有限,因此无法使用)。 因此,有必要用替代的“阳性”对照(生成或采购)来近似人类ADA的特征并确保一致的方法性能。为了确保在患者人群中可能遇到的各种亲和力范围内检测ADA,人们可能希望使用至少代表高亲和力和低亲和力的单克隆ADA“阳性对照”试剂进行免疫测定。然而,由于与购买这种试剂有关的实际挑战,很少使用阳性对照。取而代之的是,通常使用动物抗血清或从中纯化得到的多克隆ADA制剂作为阳性对照试剂,这些制剂通常由于基于佐剂的超免疫反应而具有很高的亲和力。或者,使用具有药物反应性的小鼠或大鼠单克隆抗体。由于抗体的产生和成熟所固有的难以置信的多样性,单个单克隆或多克隆试剂通常具有独特的结合特性。尽管试剂抗体(“替代” ADAs)的这些独特特征(例如表位,结合亲和力,抗体同种型,pH耐受性)可以实现灵敏而稳健的方法开发和验证,但对于检测具有临床意义的ADA可能不是最佳选择。由于人类蛋白是其他物种中的外源抗原,因此动物衍生的ADA通常与人类抗体相比结合在同一抗原上的不同表位。 ADA方法对基质成分(包括过量药物或过量靶标)产生干扰的敏感性,特异性和敏感性直接取决于试剂抗体或用于开发和验证方法的抗体。实际上,如果使用一组抗体来评估单个方法的敏感性,那么即使使用相同的方法,每种抗体的敏感性也会有所不同。此外,该方法中使用的辅助试剂通常会与结合剂(例如生物素或链霉亲和素),酶(例如碱性磷酸酶或辣根过氧化物酶),荧光染料(例如Alexa Fluor)或化学发光示踪剂(例如钌( II)三联吡啶(4-甲基砜),其共轭比在实验室之间经常不同。这些警告不仅意味着适用于检测阳性对照抗体的完善的实验室方法可能会低报临床相关的ADA,而且强调一种ADA方法的结果无法与另一方法的结果进行比较。当不同的实验室使用不同的(通常是专有的)阳性对照和试剂为同一生物开发ADA方法时,未经广泛的交叉验证,不得将其各自的测试结果视为等同。
在大多数免疫原性评估方案中,通常在样品中检测结合的ADA之后再进行其他药物中和测试。在这种体外测试方法中,对样品评估其减弱药物药理活性或效力的能力进行了评估(图2)。推断会对药物效力产生不利影响的ADA阳性样品中含有NAb。相反,推断不会降低药物效力的ADA阳性样品包含非NAb。为了评估中和活性,通常使用两种类型的方法:生物测定法(即基于细胞培养的测试方法)或竞争性配体结合免疫测定法。通常,生物测定法是首选的检测相对于具有较高ADA介导临床后果风险的生物制品的NAb的方法。此类方法通常使用可产生可测量反应(例如增殖,信号分子生成或报告基因激活)的细胞系)接触药物时。如图3a,b所示,当结合时,非中和的ADA与生物药物功能相互作用得以保留,并且细胞对药物的反应是可检测的。相反,NAb将阻断靶标结合并部分或完全抑制细胞反应。当标记的靶标可以结合粘附在测定板上的药物时,竞争性配体结合免疫测定会产生信号。包含ADA的测试样品的特征在于,将ADA捕获在板结合的药物上,并在标记的靶标存在下测量测定信号。如图3c,d所示,非NAb允许板结合的药物与靶标缔合,从而产生测定信号,但NAb阻断了板结合的药物与标记靶标的相互作用,从而降低了测定信号。

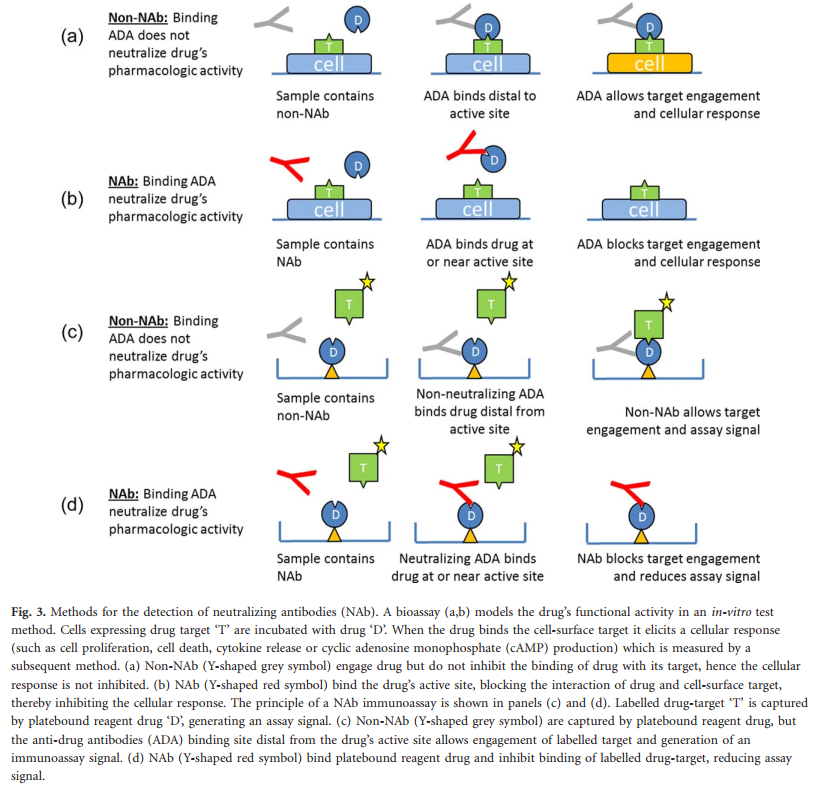
在生物测定法和竞争性配体结合免疫测定法中,药物活性的药理中和作用通常以抑制百分比的形式进行评估,并将结果与确定的临界值进行比较。抑制百分分数大于或等于方法临界点的样品被认为对NAbs呈阳性。当将生物测定法用于NAb评估时,与用于检测结合ADA的“筛选”测定法相比,测定法灵敏度通常较差。同样,NAb免疫测定通常比NAb生物测定更敏感。像结合ADA方法一样,每种NAb生物测定方法都取决于用于开发该方法的试剂和技术平台。由于细胞对药物的反应敏感性,细胞活力的变化,细胞周期的阶段,细胞培养基,未知和不受控制的分泌和外源添加的生长因子,孵育时间,细胞培养板的类型和形状等,生物测定法具有很大的可变性这种差异会影响测定的灵敏度和准确性。基于免疫测定的NAb方法,适用于NAb测试时,不易出现此类问题,但也有局限性。与结合ADA方法相似,免疫分析方法受试剂(例如标记药物,标记药物靶标,对照NAb等)和所用技术平台的影响。 NAb方法也容易受到基质成分(包括过量药物或过量靶标)的干扰。
五、药物和目标物对ADA检测方法的干扰会影响结果的准确性 INTERFERENCE BY DRUG AND TARGET IN ADA DETECTION METHODS IMPACTS THE ACCURACY OF RESULTS
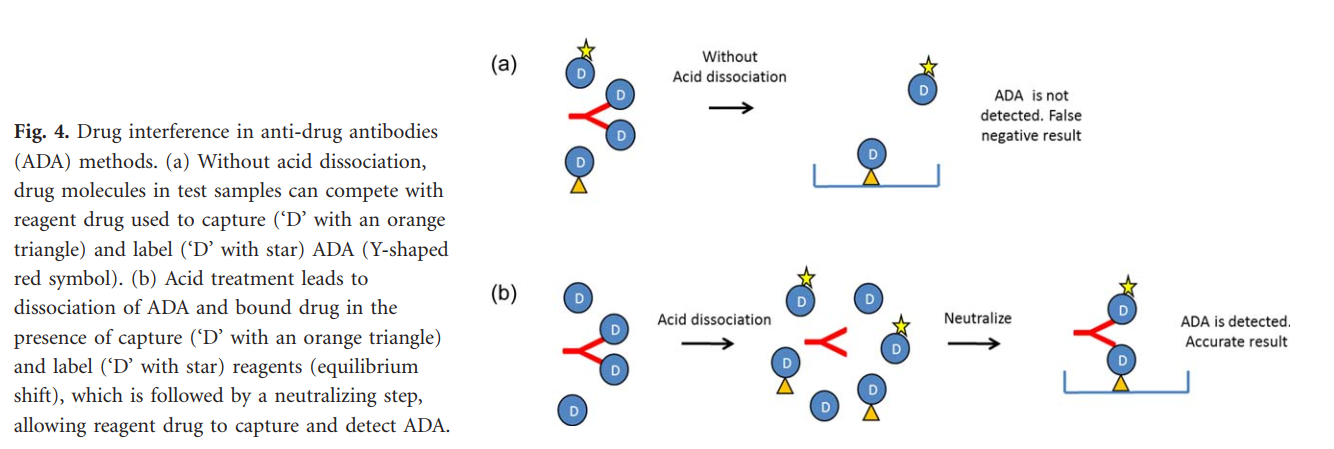
免疫测定法和生物测定法容易受到测试样品中药物的干扰。在药物结合状态下,可能无法检测到ADA和NAb的结合,从而导致假阴性结果或效价低估。因此,据报道,大多数生物制剂的免疫原性大约在2010年之前就被批准的可能被低估了。
近年来,人们已经认识到要克服药物干扰,必须破坏现有的药物-ADA免疫复合物,以使平衡发生变化,从而有利于结合免疫测定试剂。这种分子破坏是通过在ADA和NAb免疫测定中包括一个酸预处理步骤来完成的(图4)。开发这种“药物耐受”的ADA检测方法可将pH降低至ADA药物复合物解离但ADA不变性的范围。将酸化的样品暴露于捕获和/或检测试剂以实现ADA结合和检测。通过pH操纵使ADA-药物复合物解离,在存在分析捕获和检测试剂的情况下,平衡发生了变化,而且以前结合且无法检测到且没有酸解离的ADA变得容易识别。通过这种方法,大多数药物耐受性ADA检测方法都可以测量药物含量超过测试样品中通常预期浓度的样品中的ADA。因此,来自监管卫生当局的指导文件建议开发ADA检测方法,以解决药物干扰问题。此外,卫生当局已要求许多制药公司用较新的,耐药性的方法代替较旧的ADA检测方法。使用新的药物耐受方法(由于技术的进步,与原始方法相比,其敏感性也可能有所提高),来重新测试临床试验样品(交叉验证)可以鉴定出以前未检测到的ADA阳性样品,从而增加报告的免疫原性率。至关重要的是,应通过与历史临床样本的交叉验证来评估旧方法与改进方法之间的检测差异。如果仅在一项新的临床试验中使用了改进的方法(例如,具有更高的灵敏度或检测以前被药物掩盖的较弱反应的能力),则意料不到的高免疫原性可能会被错误地解释为药物具有更高的免疫原性。
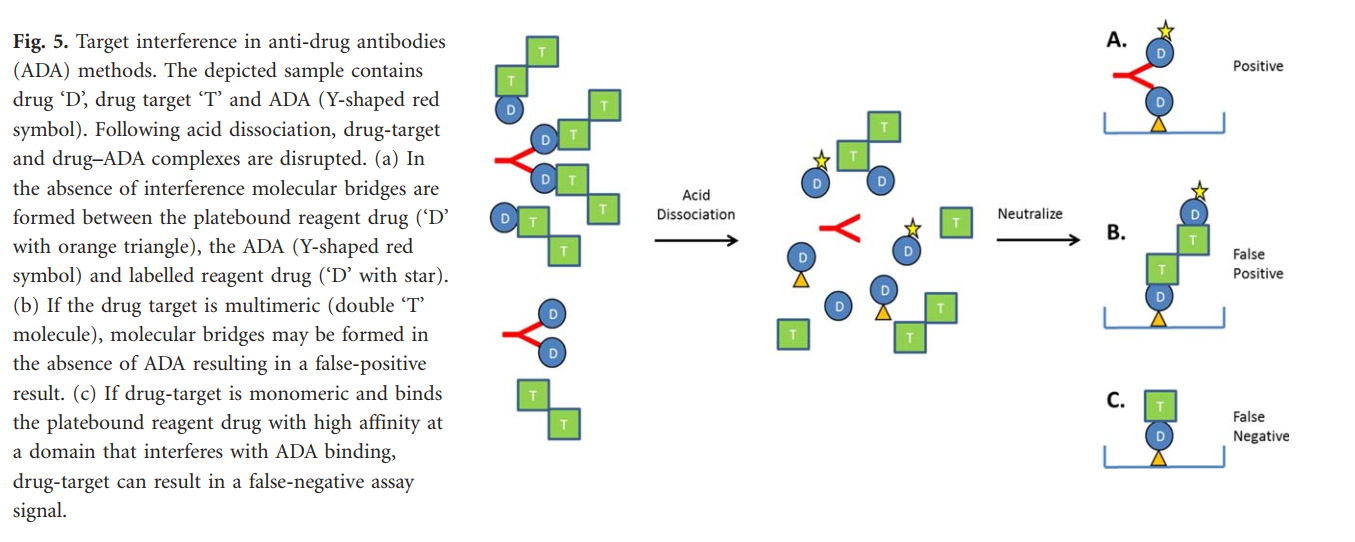
除药物干扰外,另一种干扰物最近已被确定为ADA检测方法的主要问题-药物的可溶性靶标。与活性,未结合的靶标相比,与小蛋白靶标(例如细胞因子)结合的拮抗生物(例如mAb)通常保留更多的“结合靶标”。该靶标在给药后处于结合状态对于患者而言,在不涉及酸解离的较老的ADA检测方法中(通常在药物干扰成为问题的情况下),通常不会引起分析干扰。但是,“新的和改良的”药物耐受性ADA检测方法可能易于靶向干扰,因为酸化步骤不仅破坏了药物-ADA复合物,而且破坏了药物-靶标复合物,可能释放了药物靶标的超生理水平。根据目标是单个表位的单体还是由两个或多个相同亚基(同二聚体,多聚体或带有多个相同表位的药物分子)组成,这可能导致假阳性或阴性结果。图5,多亚基药物靶标可以在测定方法中形成分子桥,从而导致假阳性测定结果。同样,单体靶标会结合到测定中,导致假阴性结果。因此,酸解离溶液对药物干扰的原始问题导致了靶干扰的新问题,该问题经常未被发现和修复。最近的出版物证明了从测试样品中去除目标以减轻这种现象并提高准确性。如该论文所述,只有在健康志愿者和接受富兰尼单抗(抗NGF拮抗剂mAb)治疗的骨关节炎受试者使用基于酸解离的方法显示出完全不同的ADA发病结果后,才认识到神经生长因子(NGF)的干扰(健康志愿者中3%,骨关节炎患者中72%)。在骨关节炎患者中,处于药物结合状态的二聚体NGF积累到超生理水平,但在健康志愿者中显然没有,产生了ADA假阳性结果。通过加入额外的靶标捕获步骤以减轻NGF干扰,发现治疗的患者与健康志愿者的ADA发病率相似。因此,如果不解决药物和靶标的干扰,可能会导致免疫原性结果不准确,以及ADA对药物安全性和功效的影响的解释不正确。
六、ADA方法的比较或不同生物产品的免疫原性结果不当
尽管比较两种生物的免疫原性和特征可能很诱人,但这些比较可能会产生误导。
- 如前所述,方法上的差异使免疫原性数据的跨方法比较变得不合适。
- 此外,广泛的语义(wide‐ranging semantics)和可变的ADA采样策略,分析和报告方法使公共信息更加混乱。
- 不同的实验室方法可能已将不同的统计方法应用于测定的切点计算(基于1·65、2或3个标准差;请注意1·65更好,因为其他方法带来更高的假阴性结果风险),或者一个可能使用了基于滴定度的方法,而另一个可能使用了基于定量校正曲线的方法。
- 最后但并非最不重要的一点是,两个同类生物的临床试验可能采用了不同的ADA采样时间表,一个带有适当选择的检测ADA的时间点,另一个没有。
在没有适当设计的时间点的情况下,研究可能会低估ADA的发病率。尽管最近的出版物提供了一些有关基于风险的方法的指南,但尚无关于ADA采样时间点的监管标准。使用基于风险的方法可能会导致免疫原性评估的频率和时间差异很大。采样时间点应该足够频繁,以提供对ADA响应动力学的理解。例如,在生物给药后仅2-3周内采集样品通常不足以形成强大的基于IgG的免疫反应,因此无法检测到ADA,而在等间隔的三个月内采集的样品则不足3个月用药后通常就足够了。对于具有较高免疫原性风险的生物制剂,可能需要在研究后的整个随访期间(对于长期给药的药物可能需要更长的时间)继续取样,以确保充分捕获临床免疫原性后遗症。因此,即使两种方法经过交叉验证并被认为是等效的,研究设计和采样方案之间的差异也会产生不同的结果,这些结果可能被误认为是免疫原性的真正差异。
其他差异值得指出。 ADA响应可以称为“瞬态”或“持久”,但从历史上看,这些术语的定义不一致。最近,行业和卫生当局的专家发表了一份白皮书,建议采用统一的方法来评估和报告对生物制剂的临床免疫原性。建议避免使用“瞬时”和“持久”两个词,而应使用ADA的持续时间用简单的统计术语描述:中位数和四分位数范围。同样,滴度应使用中值滴度和四分位间距来描述,而不要使用任意描述符“高”,“中”或“低” 。
因此,较高的报道的ADA发生率不应自动视为一种药物的免疫原性比另一种药物低。其他考虑因素,如已报道的ADA潜在临床表现(如输注或超敏反应的发生率),或随着时间的流逝功效下降,也可以指导药物治疗的选择。重要的是要记住,尽管ADA的发病率相对较高,但许多生物制剂已被证明是安全有效的。
七、结论
所有生物制剂都能够在治疗的受试者中引发免疫反应,从而导致ADA的发展。不能使用单一的通用ADA检测方法,也不能使用任何此类NAb方法。这些方法对于每种药物和测试基质(血清,血浆等)都是唯一的,并且经常利用各种方法论方法和技术平台,每种方法都有其固有的优势和警告。因此,尽管比较不同药物之间报告的免疫原性或中和的发生率可能很诱人,但这是不适当的,并且可能会造成很大的误导。对于每种方法,方法对各种干扰物质的敏感性和耐受性是独特的,并定义了限制,在给定研究设计和采样时间点的情况下,各个方法可以检测测试样品中的ADA。此外,即使对于同一类别的生物,免疫原性结果的报告和呈现在历史上也是不一致的。因此,至关重要的是要了解分析方法和研究细节,以便准确地理解
参考资料
- From the bench to clinical practice: understanding the challenges and uncertainties in immunogenicity testing for biopharmaceuticals。 Clin Exp Immunol. 2016 May; 184(2): 137–146. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4837239/
